तत्त्वों का वर्गीकरण और उनके समूहों की पहचान करने के लिए कई वैज्ञानिकों ने महत्वपूर्ण सिद्धांत दिए हैं। यहाँ डोबेराइनर का त्रिक का नियम, न्यूलैंड का अष्टक नियम, और लोथर मेयर के वक्र के बारे में बताया गया है यहाँ तत्त्वों का वर्गीकरण डॉबेराइनर के त्रिक | न्यूलैंड का अष्टक नियम | लोथर मेयर के वक्र से संबंधित सभी महत्वपूर्ण जानकारी दी गई है। इस आर्टिकल में –
- डॉबेराइनर के त्रिक
- डी – चेनकोरटोइस का वर्गीकरण
- न्यूलैंड का अष्टक नियम
- लोथर मेयर के वक्र को समावेश किया है
तत्त्वों का वर्गीकरण क्यों आवश्यक है ?
प्रारम्भ में ज्ञात तत्त्वों की संख्या बहुत कम थी अत : उनके वर्गीकरण की आवश्यकता ही नहीं थी लेकिन सन् 1865 तक ज्ञात तत्त्वों की संख्या 63 हो गयी थी तथा आज हमें 114 तत्त्वों के बारे में ज्ञात है तथा आगे भी तत्त्वों की खोज जारी है।
तत्त्वों की इतनी अधिक संख्या तथा इनके असंख्य यौगिकों के रसायन का अलग – अलग अध्ययन करना बहुत मुश्किल था।
अत : वैज्ञानिकों ने तत्त्वों का वर्गीकरण किया तथा इनके ज्ञान को संगठित किया ताकि इनका अध्ययन आसान हो सके।
इस तरीके से सभी तत्त्वों से सम्बन्धित रासायनिक तथ्यों को तर्कसंगत किया जा सकेगा तथा भविष्य में खोजे जाने वाले अन्य तत्त्वों का अध्ययन भी आसान हो सकेगा।
तत्त्वों का समूहों में वर्गीकरण , आवर्त नियम तथा आवर्त सारणी का विकास , विभिन्न वैज्ञानिकों द्वारा किये गए अनेक प्रयोगों तथा अवलोकनों से प्राप्त ज्ञान को सुव्यवस्थित करने का ही परिणाम है।
डोबेराइनर का त्रिक का नियम
सर्वप्रथम 1829 में जर्मन रसायनज्ञ डॉबेराइनर ने बताया कि तत्त्वों के गुणधर्मों में निश्चित प्रवृत्ति होती है तथा उन्होंने समान भौतिक एवं रासायनिक गुणों वाले तीन तत्त्वों के समूहों ( त्रिकों ) के बारे में जानकारी दी ।
उन्होंने एक त्रिक नियम दिया जिसके अनुसार तीन – तीन तत्त्वों के समूहों ( त्रिकों ) में बीच वाले तत्त्व का परमाणु भार शेष दोनों तत्त्वों के परमाणु भार के औसत मान के लगभग बराबर होता है तथा मध्य वाले तत्त्व के गुणधर्म भी शेष दोनों तत्त्वों के गुणधर्मों के मध्य होते हैं । इस नियम को डोबेराइनर का त्रिक का नियम कहते हैं।
eg. Li=7, Na=23, K=39
Na=(7+39)/2
Na=23
:: डॉबेराइनर का त्रिक नियम कुछ ही तत्त्वों पर लागू हो पाया अतः इसे मात्र एक संयोग मानकर छोड़ दिया गया ।
डी – चेनकोरटोइस का वर्गीकरण
सन् 1862 में ए.ई.बी. डी – चेनकोरटोइस ने तत्त्वों को परमाणु भार के बढ़ते क्रम में व्यवस्थित करके तत्त्वों की एक वृत्ताकार सारणी बनायी जिसमें तत्त्वों के गुणधर्मों में आवर्ती पुनरावृत्ति को प्रदर्शित किया । लेकिन यह वर्गीकरण सफल नहीं हो सका ।
न्यूलैंड का अष्टक नियम
सन् 1865 में अंग्रेज रसायनज्ञ जॉन एलेक्जेंडर न्यूलैंड ने भी तत्त्वों के वर्गीकरण में महत्त्वपूर्ण योगदान दिया तथा उसने तत्त्वों को परमाणु भार के बढ़ते क्रम में रखकर एक नियम दिया ।
जिसके अनुसार तत्त्वों को परमाणु भार के बढ़ते क्रम में व्यवस्थित करके , किसी भी तत्त्व से प्रारम्भ करने पर आठवें तत्त्व के गुण प्रथम तत्त्व के समान होते हैं ,
जैसे – संगीत में आठवाँ स्वर पहले स्वर के समान होता है ( सा रे गा मा पा धा नि सा ) , इसे न्यूलैंड का अष्टक नियम कहते हैं ।
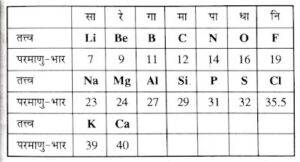
न्यूलैंड्स के अष्टक नियम की सीमाएं :
- अष्टक का सिद्धांत केवल कैल्शियम पर लागू होता था, क्योंकि कैल्शियम के बाद प्रत्येक आठवें तत्व में पहले तत्व के गुण नहीं होते हैं।
- न्यूलैंड्स ने कल्पना की थी कि प्रकृति में केवल 56 तत्व मौजूद हैं और भविष्य में कोई अन्य तत्व नहीं मिलेगा। लेकिन, बाद में कई नए तत्व मिले जिनके गुण अष्टक सिद्धांत से मेल नहीं खाते।
- न्यूलैंड्स के अष्टक सिद्धांत को केवल हल्के तत्वों पर ही ठीक से लागू किया गया है।
- न्यूलैंड का अष्टक नियम केवल कैल्सियम तक ही लागू हो पाया बाद में उत्कृष्ट गैसों की खोज हुई जिनको इसमें शामिल करने पर यह नियम लागू नहीं हो पाया ।
लोथर मेयर के वक्र Lothar Meyer’s Curve
सन् 1869 में लोथर मेयर ने तत्त्वों के भौतिक गुणों , जैसे परमाण्वीय आयतन , गलनांक , क्वथनांक तथा परमाणु भार के मध्य आलेख बनाए , तो देखा कि समान गुणों वाले तत्त्व समान स्थिति पर होते हैं अतः ये एक निश्चित समूह वाले तत्त्वों में समानता दर्शाते हैं । इन्हें लोथर मेयर के वक्र कहते हैं ।
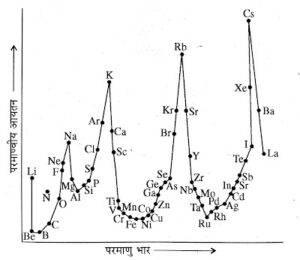
लोथर मेयर के वक्र से प्राप्त निष्कर्ष :
- प्रबल विद्युत धनी तत्त्व ( क्षार धातु- Li के अतिरिक्त ) जैसे Na , K , Rb तथा Cs वक्रों के शिखर पर पाए गए ।
- कुछ कम विद्युत धनी तत्त्व ( क्षारीय मृदा धातु ) जैसे Be , Mg , Ca , Sr तथा Ba वक्रों के अवरोही भाग के मध्य पाए गए ।
- हैलोजेन तथा उत्कृष्ट गैसें ( He के अतिरिक्त ) वक्रों के आरोही भाग पर पायी गयीं ।
- संक्रमण तत्त्व , इन वक्रों में एकदम नीचे क्षैतिज भागों पर पाए गए ।

Lothar Meyer vargikaran ko niyat kyu Kiya Gaya