यहाँ मोल अवधारणा [ mole concept in Hindi ] मोल संकल्पना और मोलर द्रव्यमान से संबंधित सभी महत्वपूर्ण जानकारी दी गई है। इस आर्टिकल में मोल संकल्पना और मोलर द्रव्यमान मोल क्या है ? परिभाषा मोल सिद्धांत क्या है ? मोल अवधारणा, आवोगाद्रो संख्या किसे कहते हैं ? मोलर द्रव्यमान किसे कहते हैं ? मोलर द्रव्यमान की परिभाषा मोल अवधारणा मोल संकल्पना से सम्बन्धित महत्त्वपूर्ण सूत्र को समावेश किया है
मोल क्या है ? मोल का अर्थ परिभाषा
मोल ( mole ) शब्द का अर्थ है ढेर अर्थात् बहुत अधिक । परमाणु तथा अणुओं का आकार बहुत छोटा होता है , अत : किसी पदार्थ की बहुत कम मात्रा में भी इनकी संख्या बहुत अधिक होती है । इतनी बड़ी संख्याओं के साथ काम करने के लिए इतने ही परिमाण का एक मात्रक , मोल प्रयुक्त किया गया ।
अत : बहुत छोटे कणों ( परमाणु , अणु , इलेक्ट्रॉन तथा आयन इत्यादि ) को गिनने के लिए मोल अवधारणा का प्रयोग किया जाता है ।
अत : किसी पदार्थ की मात्रा को व्यक्त करने के लिए SI मात्रक, मोल ( संकेत : mol ) होता है ।
मोल सिद्धांत क्या है ? मोल अवधारणा [ Mole Concept In Hindi ]
किसी पदार्थ का एक मोल उसकी वह मात्रा है, जिसमें उतने ही कण ( रासायनिक इकाइयाँ ) होते हैं , जितने शुद्ध C-12 समस्थानिक के 12g में परमाणुओं की संख्या होती है ।
यह ध्यान देने योग्य है कि प्रत्येक पदार्थ के एक मोल में कणों की संख्या हमेशा समान होती है ।
इस संख्या के सही निर्धारण के लिए C – 12 परमाणु का द्रव्यमान , द्रव्यमान स्पेक्ट्रममापी द्वारा ज्ञात किया गया जो कि 1.992648 ×10-23 प्राप्त हुआ ।
कार्बन के 1 मोल का द्रव्यमान अतः कार्बन के 1 मोल में परमाणुओं की संख्या =
\frac{12 g / mol C^{12}}{1.992648 \times 10^{-23}g / C^{12}}
= 6.0221373 ×1023 परमाणु प्रति मोल ( आवोगाद्रो संख्या )
आवोगाद्रो संख्या किसे कहते हैं ?
किसी पदार्थ के 1 मोल में उपस्थित कणों की संख्या को आवोगाद्रो संख्या कहते हैं । इसका संकेत NA है तथा आवोगाद्रो संख्या का मान 6.022 × 1023 होता है ।
अतः किसी पदार्थ के 1 मोल में कणों ( परमाणु , अणु , आयन या अन्य कण ) की संख्या , हमेशा आवोगाद्रो संख्या के बराबर होगी । अत :
1 मोल Na परमाणु = 6.022×1023 Na परमाणु
1 मोल CO2अणु = 6.022×1023 CO2 अणु
1 मोल KCl = KCl की 6.022×1023
Read more : कक्षा 11 रसायन विज्ञान नोट्स Chemistry Notes
मोलर द्रव्यमान किसे कहते हैं ? मोलर द्रव्यमान की परिभाषा
मोलर द्रव्यमान — किसी पदार्थ के 1 मोल के ग्राम में व्यक्त द्रव्यमान को मोलर द्रव्यमान कहते हैं । ग्राम में व्यक्त मोलर द्रव्यमान संख्यात्मक रूप में परमाणु द्रव्यमान या आण्विक द्रव्यमान या सूत्र द्रव्यमान के बराबर होता है ।
जैसे- जल ( H2O ) का मोलर द्रव्यमान = 18.02 g mol-1
NaCl का मोलर द्रव्यमान = 58.5 g mol-1
👉 गैसीय पदार्थों में एक मोल वह मात्रा होती है जिसका मानक ताप व दाब ( NTP ) पर आयतन 22.4 L या 22400 mL होता है । इसे मोलर आयतन कहते हैं ।
मोल अवधारणा मोल संकल्पना से सम्बन्धित महत्त्वपूर्ण सूत्र
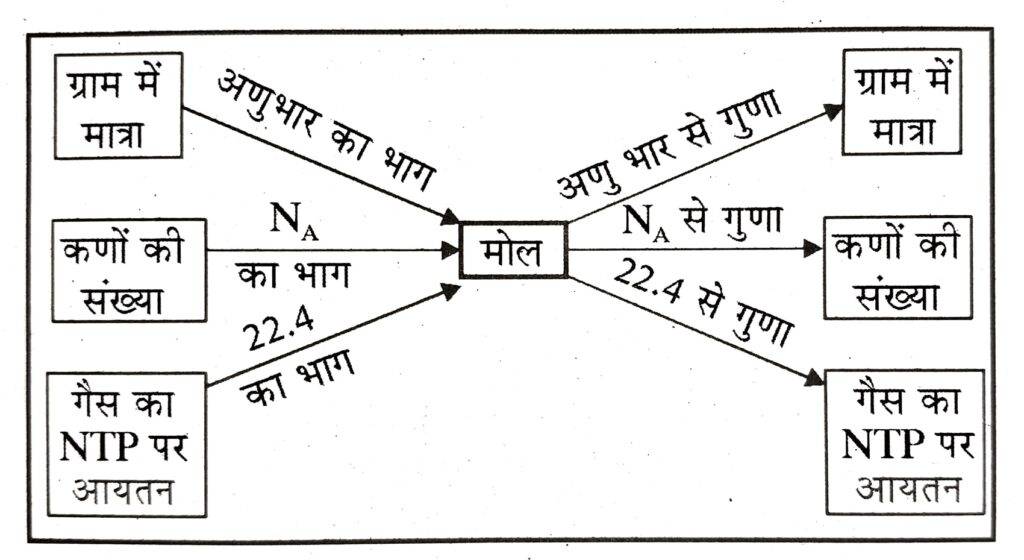
- 👉 मोल या ग्राम मोल = पदार्थ का द्रव्यमान ( ग्राम में )/ पदार्थ का मोलर द्रव्यमान (आण्विक द्रव्यमान or परमाणु द्रव्यमान or आयनिक द्रव्यमान)
- 👉ग्राम अणु या ग्राम अणुभार = अणुभार ( ग्राम में ) = 1 मोल अणुओं का भार
- ग्राम परमाणु या ग्राम परमाणु भार = परमाणु भार ( ग्राम में ) = 1 मोल परमाणुओं का भार
- ग्राम आयन या ग्राम आयनिक भार = आयन का भार ( ग्राम में ) = 1 मोल आयनों का भार
- 👉अणु भार = 2× वाष्प घनत्व
- 👉परमाणु भार × विशिष्ट ऊष्मा = 6.4
- 👉 ग्राम मोल या मोल =अणुओं की संख्या or परमाणुओं की संख्या or आयनों की संख्या / आवोगाद्रो संख्या (NA)
- 👉 ग्राम मोल = किसी गैस का NTP पर आयतन (लीटर)/22.4
- 👉 किसी पदार्थ के एक परमाणु का द्रव्यमान = परमाणु द्रव्यमान /6.022 × 1023
किसी पदार्थ के एक अणु का द्रव्यमान = आण्विक द्रव्यमान /6.022 × 1023 - 👉 किसी गैस के एक अणु का आयतन = 22.4 लीटर (NTP पर) /6.022 × 1023
Read more – कक्षा 11 रसायन विज्ञान की कुछ मूल अवधारणाएँ नोट्स
