गैस के नियम – बॉयल चार्ल्स गै-लुसैक का नियम – गैस के नियम [ The Gas Laws in Hindi ] सभी गैसों के लिए एक सामान्य नियम यह है कि इनके ताप या दाब में परिवर्तन करने पर इनके आयतन में भी परिवर्तन होता है ।
अतः ताप , दाब तथा आयतंन के मध्य सम्बन्धों का विस्तृत अध्ययन विभिन्न वैज्ञानिकों द्वारा किया गया तथा गैसों के लिए कुछ नियम दिए जिन्हें गैस नियम कहते हैं , जो कि उन वैज्ञानिकों के नाम से ही प्रचलित हैं जिनके द्वारा ये दिए गए हैं ।
- बॉयल का नियम ( दाब आयतन सम्बन्ध )
- बॉयल नियम का ग्राफीय निरूपण
- चार्ल्स का नियम
- चार्ल्स नियम का ग्राफीय निरूपण
- गै-लुसैक नियम
- गै-लुसैक नियम का ग्राफीय निरूपण
- आवोगाद्रो नियम ( आयतन – मात्रा सम्बन्ध )
से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
बॉयल का नियम ( दाब आयतन सम्बन्ध )
[ Boyle’s Law ( Pressure – volume Relationship ) ]
यह नियम दाब तथा आयतन में सम्बन्ध दर्शाता है । स्थिर ताप पर किसी गैस की निश्चित मात्रा ( मोलों की संख्या ) का दाब , उसके आयतन के व्युत्क्रमानुपाती होता है । इसे बॉयल का नियम कहते हैं ।
P\propto\frac{1}{V}P\propto k_1\frac{1}{V}k1 = समानुपातिक स्थिरांक
PV=K1 अर्थात् स्थिर ताप पर गैस की निश्चित मात्रा के आयतन तथा दाब का गुणनफल स्थिर होता है ।
स्थिरांक k1 का मान , गैस की मात्रा , ताप तथा P व V की इकाइयों पर निर्भर करता है ।
यदि किसी गैस की निश्चित मात्रा को स्थिर ताप T पर दाब P1 तथा आयतन V1 से प्रसारित किया जाता है ( जिससे आयतन V2 तथा दाब P2 हो जाए ) , तो बॉयल के नियमानुसार
P_1V_1=P_2V_2
\frac{P_1}{P_2}=\frac{V_2}{V_1}बॉयल नियम का ग्राफीय निरूपण
स्थिर ताप और स्थिर भार पर P और V के मध्य समतापीय ग्राफ (आइसोथर्म) कहलाता है और यह समपार्वीय ( या आयताकार ) या अतिपरवलयाकार ( Hyperbola ) होता है , P और 1 / V के बीच ग्राफ खींचने पर अतिपरवलयाकार ग्राफ सरल रेखा में बदल जाता है ।
बाँयल के प्रयोग से यह सिद्ध होता है कि गैसें अत्यधिक सम्पीड्य होती हैं क्योंकि जब किसी गैस की निशिचत मात्रा को संपीडित किया जाता है तो उसके अणु बहुत कम स्थान घेरते हैं अर्थात् ठच्च दाब पर गैस सघन हो जाती है।
बॉयल के नियम से गैस के घनत्व तथा दाब के मध्य एक सम्बन्ध प्राप्त किया जा सकता है-
चैंकि,
\begin{aligned}
\text { घनत्व } &=\frac{\text { द्रव्यमान }}{\text { आयतन }} \\
\mathrm{d} &=\frac{\mathrm{m}}{\mathrm{V}} \\
\mathrm{V} &=\frac{\mathrm{m}}{d}
\end{aligned}
P \frac{m}{d}=k_{1} \\
d=\left(\frac{m}{k_{1}}\right) \mathrm{P}
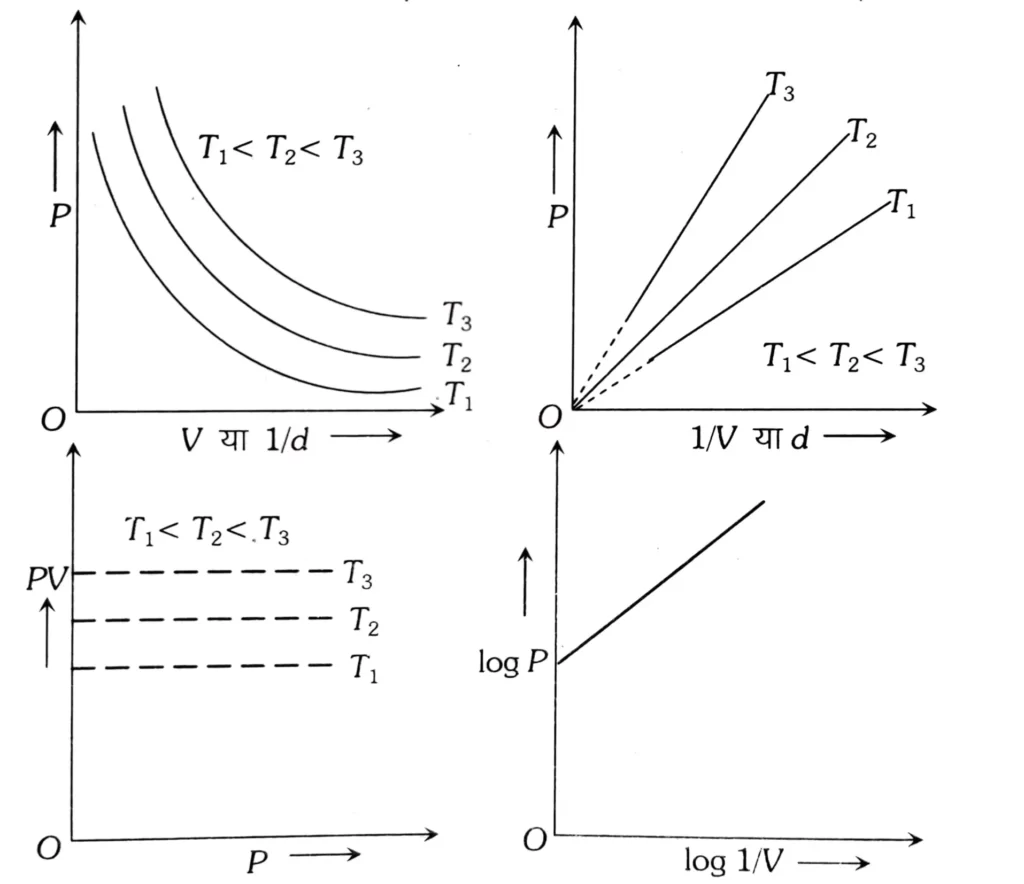
अर्थात् स्थिर ताप पर गैस के निश्चित द्रव्यमान का दाब घनत्व के समानुपाती होता है या एक निश्चित द्रव्यमान की गैस के घनत्व तथा दाब का अनुपात स्थिर होता है।
चार्ल्स का नियम ( ताप – आयतन सम्बन्ध )
[ Charles Law (Temperature – Volume Relationship)]
चार्ल्स ने स्थिर दाब पर गैस के आयतन पर ताप के प्रभाव का अध्ययन किया तथा बाद में गै – लूसैक ने इसे प्रमाणित किया तथा पाया कि स्थिर दाब पर निश्चित द्रव्यमान वाली गैस का ताप बढ़ाने पर उसका आयतन बढ़ता है
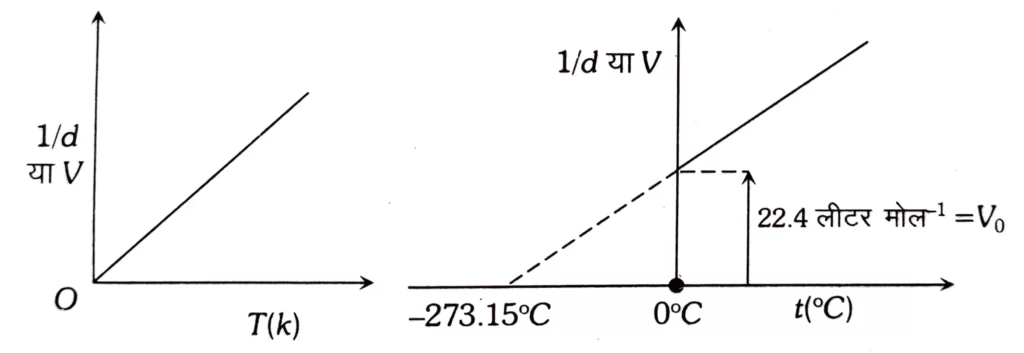
उन्होंने देखा कि ताप की प्रत्येक डिग्री में वृद्धि से गैस की निश्चित मात्रा के आयतन में उसके 0°C ताप के आयतन 1/273 वें भाग की वृद्धि होती है ।
माना किसी गैस के लिए 0°C तथा t°C ताप पर आयतन क्रमशः V0 तथा Vt हो तो
V_t=V_0+\frac{t}{273.15}V_0V_t=V_0\left[1+\frac{t}{273.15}\right]V_t=V_0\left[\frac{273.15+t}{273.15}\right]
स्थिर दाब पर किसी गैस की निश्चित मात्रा का आयतन उसके परम ताप के समानुपाती होता है ।
अर्थात्
V\propto T
V=k_2T
\frac{V}{T}=k_2स्थिरांक ( k2 ) का मान , गैस की मात्रा , गैस के दाब तथा आयतन की इकाई पर निर्भर करता है ।
दो भिन्न – भिन्न आयतन तथा भिन्न – भिन्न तापों के लिए
\frac{V_1}{T_1}=\frac{V_2}{T_2}
चार्ल्स ने पाया कि स्थिर दाब पर , ताप तथा आयतन के मध्य ग्राफ एक सरल रेखा होती है जिसे समदाब कहते हैं ।
चार्ल्स नियम का ग्राफीय निरूपण :
स्थिर दाब पर V और T के मध्य ग्राफ समदाबीय होता है यह हमेशा सरल रेखा में आता है । V और t ( ° C ) के मध्य स्थिर दाब पर – 273.15 ° C पर और तापीय अक्ष पर सीधी कटी हुई रेखा के रूप में ग्राफ प्राप्त होता है यह निम्नतम् सम्भव तापक्रम होता है ।
गै-लुसैक नियम ( दाब – ताप सम्बन्ध )
[ Gay – Lussac’s Law ( Pressure – Temperature Relationship ) ]
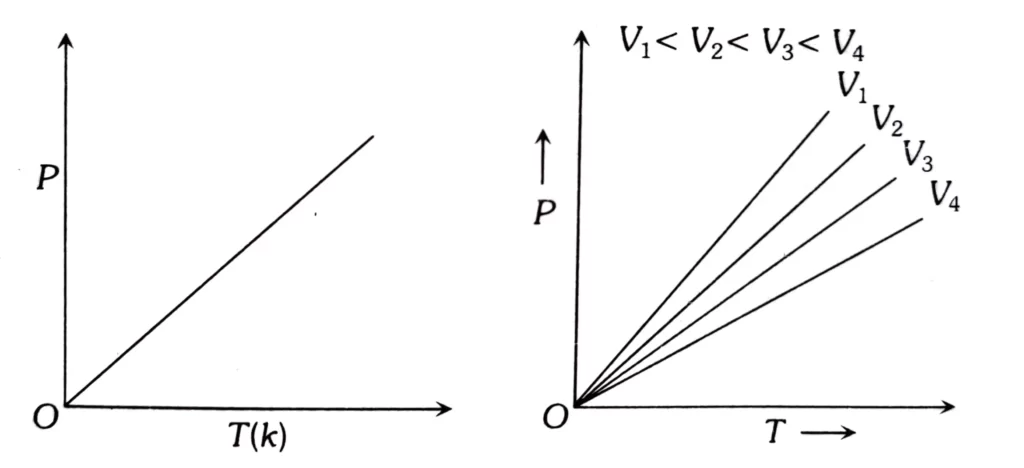
गै – लुसैक नियम स्थिर आयतन पर गैस के ताप तथा दाब के मध्य सम्बन्ध दर्शाता है । इसके अनुसार स्थिर आयतन पर किसी गैस की निश्चित मात्रा का दाब , उसके परम ताप के समानुपाती होता है ।
P\propto T
P=k_3 T
\frac{P}{T}=k_3
यदि ताप T1 पर किसी गैस का दाब P1 हो तथा ताप T2 पर उसी गैस का दाब P2 हो तो
गैस का आयतन तथा द्रव्यमान स्थिर होने पर
\frac{P_1}{T_1}=\frac{P_2}{T_2}
गै-लुसैक नियम का ग्राफीय निरूपण
स्थिर आयतन पर P तथा T के मध्य ग्राफ ( आइसोकोर ) समआयतनी वक्र कहलाता है और यह सरल रेखा में आता है ।
आवोगाद्रो नियम ( आयतन – मात्रा सम्बन्ध )
[ Avogadro Law ( Volume – Amount Relationship ) ]
सन् 1811 में आवोगाद्रो ने डाल्टन के परमाणु सिद्धान्त तथा गै लुसैक के संयुक्त आयतन सिद्धान्त के संयुक्त निष्कर्ष के आधार पर एक नियम दिया जिसे आवोगाद्रो नियम कहते हैं ।
इसके अनुसार समान ताप व दाब पर विभिन्न गैसों के समान आयतन में अणुओं की संख्या समान होती है ।
अर्थात् स्थिर ताप व दाब पर गैस का आयतन , उसके अणुओं की संख्या या गैस की मात्रा पर निर्भर करता है । गैस की मात्रा को मोल में व्यक्त किया जाता है । अतः
V\propto n
V=Kn
V = Kn किसी गैस के एक मोल में अणुओं की संख्या 6.022 x 1023 होती है जिसे आवोगादो संख्या ( NA ) कहते हैं । चूँकि गैस का आयतन , उसके मोलों की संख्या के समानुपाती होता है ।
अतः मानक ताप व दाब ( STP ) पर प्रत्येक गैस के एक मोल का आयतन समान होता है तथा STP पर आदर्श गैस के एक मोल का आयतन ( मोलर आयतन ) 22.7 Lmol-1 होता है ।
