जो गैस नियमों या आदर्श गैस समीकरण ( PV = nRT ) का सभी ताप और दाब पर पालन करती हैं आदर्श कहलाती हैं । वास्तविक और आदर्श गैसें,वास्तविक गैसों का आदर्श व्यवहार से विचलन से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
- वास्तविक और आदर्श गैसें ( Real and Ideal gases )
- वास्तविक गैसों का आदर्श व्यवहार से विचलन का कारण
जैसे महत्वपूर्ण टॉपिक से संबंधित सभी महत्वपूर्ण जानकारी है।
वास्तविक और आदर्श गैसें ( Real and Ideal gases )
गैसें ; जो गैस नियमों या आदर्श गैस समीकरण ( PV = nRT ) का सभी ताप और दाब पर पालन करती हैं ; आदर्श या पूर्ण गैसें कहलाती हैं ।
गैसों का सैद्धान्तिक मॉडल , प्रायोगिक प्रेक्षणों के संगत है लेकिन तब कठिनाई उत्पन्न होती है जब हम यह ज्ञात करने की कोशिश करते हैं कि आदर्श गैस समीकरण PV = nRT कब तक गैसों के ताप – दाब – आयतन के मध्य सम्बन्ध बनाए रखता है , इसे ज्ञात करने के लिए हम गैसों के PV तथा P के मध्य ग्राफ खींचते हैं । बॉयल के नियमानुसार , स्थिर ताप पर PV स्थिर रहना चाहिए तथा PV और P के मध्य ग्राफ ( आरेख ) अक्ष के समानान्तर सीधी रेखा होनी चाहिए ।
सामान्यतः लगभग सभी गैसें आदर्श गैस व्यवहार से विचलन प्रदर्शित करती हैं । कोई भी गैस आदर्श या पूर्ण नहीं है । अतः यह गैसें केवल सैद्धान्तिक हैं ।
ताप जैसे – जैसे बढ़ता जाता है या गैसों के क्वथनांक से ऊपर या उनके द्रवीकरण अवस्था से गुजरता है और दाब घटता जाता है ; वैसे वैसे गैसें आदर्श गैस व्यवहार को अधिक से अधिक प्रदर्शित करने लगती है । अतः “ वास्तविक गैसें ” वह गैसें है जो उच्च ताप और निम्न दाब की अवस्था में गैस नियमों या आदर्श गैस समीकरण का पालन करती हैं।”
( 3 ) P – V समतापीय ( P – V isotherms ) वक्र खींचने पर वास्तविक और आदर्श गैसों के मध्य ग्राफ निम्न प्रकार से प्रदर्शित होता है ।
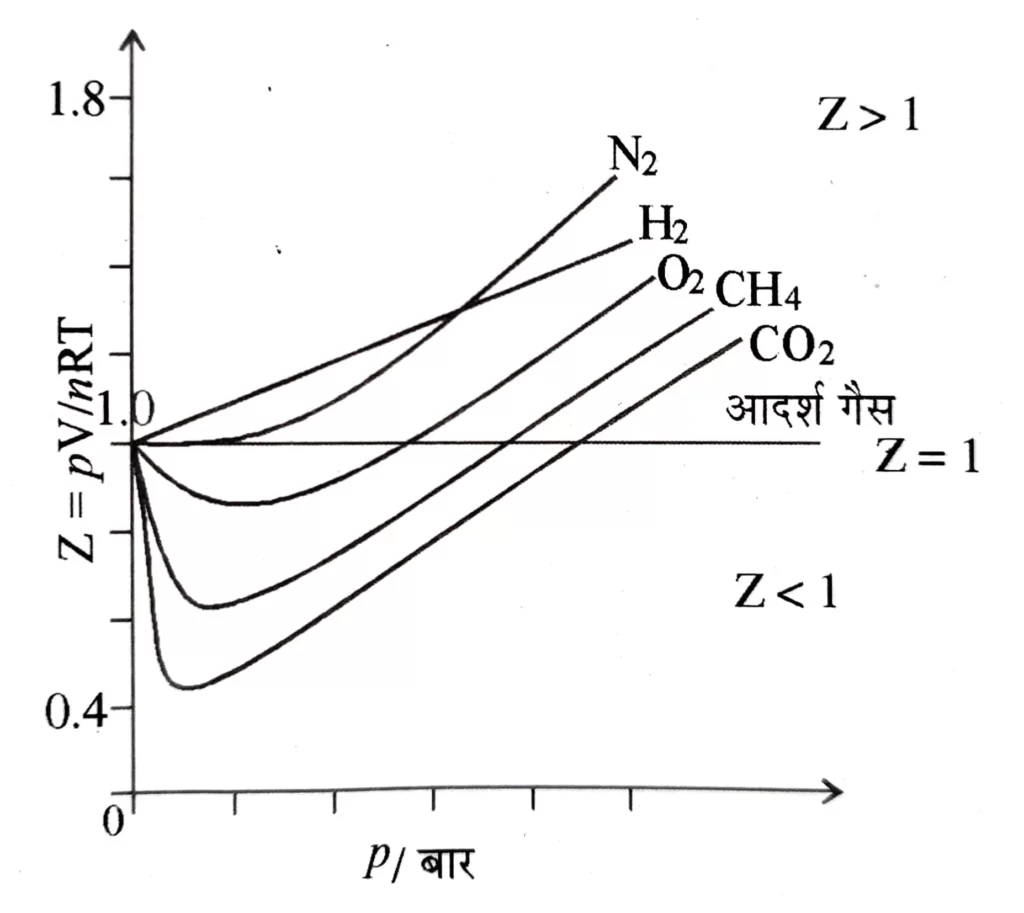
आदर्श गैस व्यवहार से वास्तविक गैसों के विचलन को P – V समतापीय वक्र द्वारा मात्रात्मक रूप से निर्धारित करना बहुत कठिन है ,
P – V समतापी वक्र चित्र में प्रदर्शित किया जा चुका है , सम्पीड़यता गुणांक 2 को निम्न समीकरण द्वारा ज्ञात किया जा सकता है । PV = ZnRT या Z = PV / nRT = PVm/ RT यह आदर्श गैस व्यवहार से विचलन को मात्रात्मक रूप से समझाने का उचित तरीका है ।
Z के मान में इकाई ( unity ) से कमी जितनी अधिक होगी गैस का आदर्श व्यवहार से विचलन उतना ही अधिक होता है इसलिये , जब
- Z = 1 , होता है तब गैस सभी ताप और दाब पर आदर्श होती है , N2 में Z का मान 50°C पर 1 के अति निकट होता है , यह वह तापक्रम है जिस पर वास्तविक गैस आदर्श व्यवहार को प्रदर्शित करती है इसे बॉयल तापक्रम या बॉयल पॉइन्ट या बिन्दु ( TB ) कहते हैं ।
- Z > 1 तब गैस आदर्श व्यवहार की तुलना में कम संपीडित होती है और यह अक्सर उच्च दाब पर धनात्मक विचलन प्रदर्शित करती हैं । PV > RT
- Z < 1 , तब गैस आदर्श व्यवहार की तुलना में अधिक संपीडित होती है और यह निम्न दाब पर ऋणात्मक विचलन प्रदर्शित करती हैं । PV < RT
- Z > 1 हाइड्रोजन के लिये सभी दाबों पर , यह हमेशा धनात्मक विचलन प्रदर्शित करती है ।
- आसानी से द्रवीकृत होने वाली और उच्च घुलनशील गैसें ( NH3 , SO2 ) आदर्श व्यवहार से अधिक विचलन को प्रदर्शित करती हैं । इनके लिये Z << 1 होता है ।
- कुछ गैसें जैसे CO2 धनात्मक और ऋणात्मक दोनों विचलन प्रदर्शित करती है ।
वास्तविक गैसों का आदर्श व्यवहार से विचलन का कारण
आदर्श गैस नियमों को गैसों के अणुगति सिद्धान्त द्वारा ज्ञात किया जा सकता है , जो कि दो महत्वपूर्ण तथ्यों पर आधारित होती है ,
- अणुओं द्वारा घेरा गया आयतन गैस के कुल आयतन की तुलना में नगण्य होता है ।
- अणुओं में परस्पर कोई आकर्षण बल नहीं होता है । इन दोनों में से किसी भी तथ्य के न होने पर गैस आदर्श व्यवहार से विचलन प्रदर्शित करने लगती है ।
