वर्ग 1 के तत्त्व : क्षार धातुएँ Group 1 Elements : Alkali Metals से संबंधित सभी महत्वपूर्ण जानकारी दी गई है। निम्न सभी टॉपिक की महत्वपूर्ण जानकारी नीचे दी गयी है
- इलेक्ट्रॉनिक विन्यास ( Electronic Configuration )
- परमाणु एवं आयनिक त्रिज्या ( Atomic and Ionic Radius )
- आयनन एन्थैल्पी ( Ionization Enthalpy )
- जलयोजन एन्थैल्पी ( Hydration Enthalpy )
- आवर्त सारणी वर्ग 1 के तत्व सामान्य भौतिक गुण
- आवर्त सारणी वर्ग 1 के तत्व सामान्य रासायनिक गुण
सामान्यतः क्षार धातुओं के भौतिक तथा रासायनिक गुणों में परमाणु क्रमांक के साथ एक नियमित प्रवृत्ति पायी जाती है । यहाँ पर क्षार धातुओं के परमाण्वीय , भौतिक तथा रासायनिक गुणों का विवेचन किया जाएगा ।
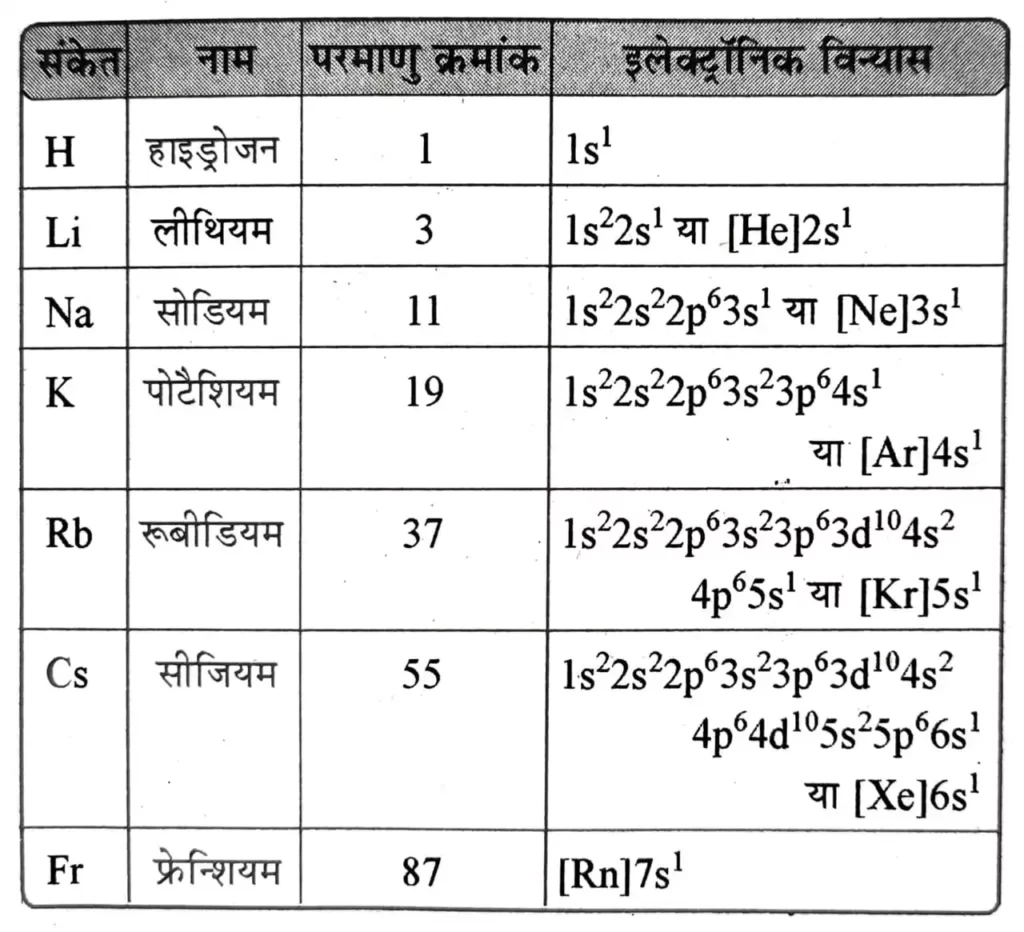
इलेक्ट्रॉनिक विन्यास ( Electronic Configuration )
वर्ग -1 के तत्त्वों का बाह्यतम सामान्य इलेक्ट्रॉनिक विन्यास ns1 होता है ( यहाँ n = 1 से 7 ) अर्थात् क्षार धातुओं के संयोजी कोश ( बाह्यतम कोश ) में एक इलेक्ट्रॉन उपस्थित होता है तथा इससे पूर्व के कोश में उत्कृष्ट गैस विन्यास पाया जाता है ।
परमाणु एवं आयनिक त्रिज्या ( Atomic and Ionic Radius )
क्षार धातुओं की परमाणु त्रिज्या ( आकार ) आवर्त सारणी के किसी आवर्त में सर्वाधिक होती है । इनके एक संयोजी आयन ( M+) का आकार अपने जनक परमाणु के आकार की तुलना में छोटा होता है ।
क्षार धातुओं की परमाणु तथा आयनिक त्रिज्या वर्ग में ऊपर से नीचे जाने पर बढ़ती है , अर्थात् इनका आकार Li से Cs तक बढ़ता है , क्योंकि कोशों की संख्या बढ़ती जाती है ।
आयनन एन्थैल्पी ( Ionization Enthalpy )
क्षार धातुओं की आयनन एन्थैल्पी का मान बहुत कम होता है । अतः ये आसानी से एक इलेक्ट्रॉन देकर उत्कृष्ट गैस विन्यास प्राप्त कर लेते हैं ।
आयनन एन्थैल्पी का मान वर्ग में लीथियम से सीजियम की ओर नीचे जाने पर कम होता जाता है क्योंकि बढ़ते हुए नाभिकीय आवेश की तुलना में बढ़ते हुए परमाणु – आकार का प्रभाव अधिक होता है तथा परिरक्षण प्रभाव भी बढ़ता है । क्षार धातुओं की आयनन एन्थैल्पी का मान अपने आवर्त में न्यूनतम होता है ।
जलयोजन एन्थैल्पी ( Hydration Enthalpy )
किसी आयन के चारों ओर जल के अणुओं के जुड़ने पर उत्सर्जित ऊर्जा को जलयोजन ऊर्जा कहते हैं । जलयोजन ऊर्जा , आयनिक त्रिज्या के व्युत्क्रमानुपाती होती है ।
क्षार धातुओं में वर्ग में आयनिक त्रिज्या बढ़ती है अतः जलयोजन एन्थैल्पी का मान कम होता जाता है । इसलिए इन आयनों की जलयोजन एन्थैल्पी का घटता क्रम निम्नलिखित है
Li+ > Na+> K+ > Rb+ > Cs+
Li+ के सबसे छोटे आकार के कारण इसकी जलयोजन ऊर्जा की मात्रा अधिकतम होती है , अतः लीथियम के अधिकांश लवण जलयोजित होते हैं ।
जैसे- LiCl.2H2O जलयोजित आयनों की गतिशीलता का क्रम जलयोजन एन्थैल्पी के विपरीत होता है ।
आवर्त सारणी वर्ग 1 के तत्व सामान्य भौतिक गुण
- भौतिक अवस्था – सभी क्षार धातु ( Li , Na , K , Rb , Cs तथा Fr ) ठोस होते हैं ।
- ऑक्सीकरण अवस्था – क्षार धातुएँ +1 ऑक्सीकरण अवस्था दर्शाती हैं क्योंकि ये एक इलेक्ट्रॉन त्यागकर स्थायी उत्कृष्ट गैस विन्यास प्राप्त करती हैं ।
- घनत्व — इनका घनत्व अन्य धातुओं से कम होता है तथा Li से Cs तक घनत्व बढ़ता है । अपवाद – K का घनत्व , Na घनत्व से कम होता है ।
- क्वथनांक तथा गलनांक- दुर्बल धात्विक बंध के कारण इनके क्वथनांक तथा गलनांक कम होते हैं ।
- आयनन एन्थैल्पी – इन तत्वों की आयनन एन्थैल्पी का मानकम होता है , अतः ये आसानी से इलेक्ट्रॉन त्यागकर धनायन बनाती हैं । M → M++ e–
- परमाणु तथा आयनिक त्रिज्या – वर्ग में बढ़ती है ।
- धनायन बनाने की क्षमता परमाण्विक त्रिज्या अधिक होने के कारण ये आसानी से धनायन बनाती हैं ।
- ज्वाला को रंग – इनमें संयोजी इलेक्ट्रॉन ढीले बंधे होने के कारण ये ज्वाला को विशिष्ट रंग प्रदान करते हैं । Li लाल , Na सुनहरी – पीला , K बैंगनी , Rb लाल – बैंगनी तथा Cs नीला रंग देता है ।
- स्त्रोत – इनके प्रमुख स्रोत पादप होते हैं ।
- प्रकाश विद्युत प्रभाव – Cs तथा K का उपयोग फोटो इलेक्ट्रिक सेल में किया जाता है ।
- रेडियोधर्मिता —87Fr रेडियोधर्मी होता है ।
आवर्त सारणी वर्ग 1 के तत्व सामान्य रासायनिक गुण
क्षार धातुएँ अत्यधिक क्रियाशील तत्व हैं ।
- वायु से क्रिया – लीथियम – ऑक्साइड , Na – परॉक्साइड एवं K , Rb तथा Cs सुपर ऑक्साइड बनाते हैं ।
4Li + O2 → 2Li2O
2Na + O2→ Na2O2
K + O2 → KO2 - (हाइड्रोजन से क्रिया- उच्च ताप पर हाइड्रोजन से क्रिया द्वारा हाइड्राइड बनते हैं ।
2M + H2 → 2 M-H
ये हाइड्राइड प्रबल अपचायक होते हैं । - नाइट्रोजन से क्रिया- लीथियम नाइट्रोजन से सीधी क्रिया करता है तथा नाइट्राइड बनाता है । वर्ग के अन्य सदस्य नाइट्रोजन से क्रिया नहीं करते हैं ।
6Li + N2 → 2Li3N - जल से क्रिया – क्षार धातुओं की जल से क्रिया अत्यन्त तीव्र वेग से होती है तथा हाइड्रॉक्साइड बनते हैं तथा इस क्रिया में हाइड्रोजन मुक्त होती है ।
2M + 2H2O → 2M-OH + H2↑ - हैलोजनों से क्रिया- इनकी हैलोजनों से क्रिया द्वारा हैलाइड बनते हैं ।
2M + X2 → 2M-X - अमोनिया में विलयन- क्षार धातु द्रव NH3 में विलेय हो जाते हैं । यह विलयन नीला होता है तथा विद्युत का सुचालक होता है ।
