रासायनिक साम्य , अभिकारकों एवं उत्पादों की साम्य अवस्था पर इस मिश्रण को साम्य मिश्रण (Equilibrium mixture) कहते हैं तथा इस अवस्था को साम्यावस्था कहते हैं। अब समझते है रासायनिक साम्य के बारे में रासायनिक प्रक्रमों में साम्यावस्था,रासायनिक साम्य की मुख्य विशेषताएँ,गुलबर्ग तथा वाजे का नियम , द्रव्य अनुपाती क्रिया का नियम,साम्य स्थिरांक की गणना जैसे महत्वपूर्ण टॉपिक को।
रासायनिक प्रक्रमों में साम्यावस्था
रासायनिक प्रक्रमों में साम्यावस्था को समझने के लिए निम्नलिखित उत्क्रमणीय अभिक्रिया पर विचार करते हैं-
A + B ⇌ C + D
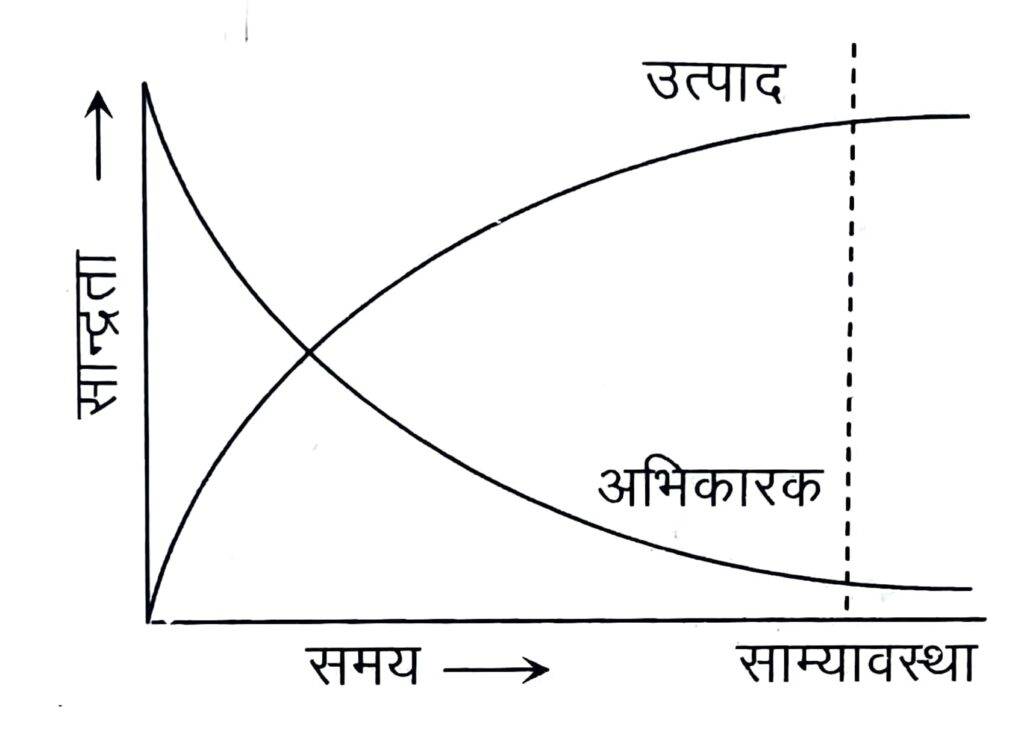
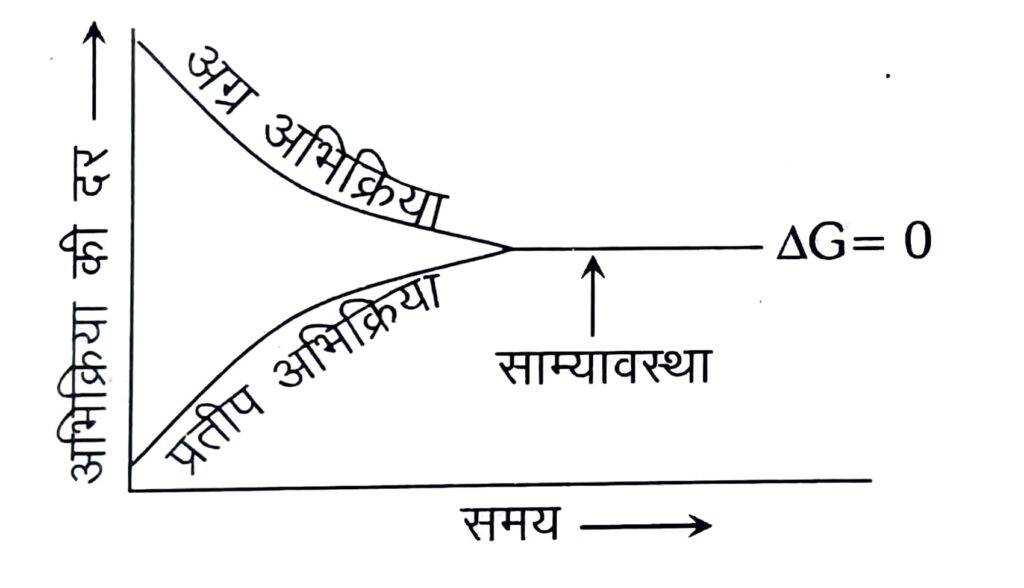
प्रारम्भ में अभिकारकों (A तथा B) की सान्द्रता अधिकतम होती है जबकि उत्पादों (C तथा D) की सान्द्रता शून्य होती है। अतः अग्र अभिक्रिया की दर उच्चतम तथा पश्च अभिक्रिया की दर निम्नतम है। क्योंकि अभिक्रिया की दर सान्द्रता के समानुपाती होती है। समय बीतने के साथ-साथ अभिकारकों (A तथा B) की सान्द्रता घटती जाती है तथा उत्पादों (C तथा D) की सान्द्रता बढ़ती जाती है। अतः अग्र अभिक्रिया की दर घटती है और प्रतीप अभिक्रिया की दर बढ़ती है तथा एक स्थिति ऐसी आती है, जब अग्र तथा पश्च अभिक्रियाओं की दर समान हो जाती है। इसे साम्यावस्था की स्थिति कहते हैं।
भौतिक साम्य की तरह रासायनिक साम्य भी गतिक होता है। साम्य पर अभिक्रिया रुक गई प्रतीत होती है क्योंकि जिस दर से अभिकारक उत्पादों में परिवर्तित होते हैं ठीक उसी दर से उत्पाद भी अभिकारकों में परिवर्तित हो जाते हैं जबकि वास्तव में अभिक्रिया रुकती नहीं है। इस साम्यावस्था को C तथा D के बीच अभिक्रिया कराकर भी प्राप्त किया जा सकता है।
C+D ⇌ A + B
समय के साथ अभिकारकों एवं उत्पादों की सान्द्रता में परिवर्तन को अग्र प्रकार दर्शाया जा सकता है-
रासायनिक साम्य की मुख्य विशेषताएँ
(i) साम्य पर सभी अभिकारकों तथा उत्पादों की सान्द्रता स्थिर हो जाती है।
(ii) किसी अभिक्रिया में उत्प्रेरक प्रयुक्त करने पर वह अग्र तथा पश्च दोनों अभिक्रियाओं की दर को समान रूप से प्रभावित करता है। अतः साम्य जल्दी स्थापित हो जाता है।
(iii) साम्य अनन्त समय तक चल सकता है यदि सान्द्रता ताप या दाब में कोई परिवर्तन नहीं किया जाता है
(iv) साम्य पर मुक्त ऊर्जा परिवर्तन (△G) शून्य होता है।
(v) साम्य पर सभी मापने योग्य गुण जैसे रंग, घनत्व, सान्द्रता,ताप तथा दाब इत्यादि स्थिर हो जाते हैं।
गुलबर्ग तथा वाजे का नियम | द्रव्य अनुपाती क्रिया का नियम
किसी अभिक्रिया की दर तथा अभिकारकों की सान्द्रता में सम्बन्ध बताने के लिए गुलबर्ग तथा वाजे ने एक नियम दिया था जिसे द्रव्य अनुपाती क्रिया का नियम (Law of Mass Action) कहते हैं
जिसके अनुसार एक रासायनिक अभिक्रिया में किसी अभिकारक की क्रिया करने की दर उसके सक्रिय द्रव्यमान (मोलर सान्द्रता) के समानुपाती होती है तथा अभिक्रिया की दर इसके सभी अभिकारकों के सक्रिय द्रव्यमानों के गुणनफल के समानुपाती होती है।
सक्रिय द्रव्यमान को दर्शाने के लिए यौगिक के सूत्र को बड़े कोष्ठक में लिखा जाता है।
जैसे [NH3] = NH3 का सक्रिय द्रव्यमान
सक्रिय द्रव्यमान (Active Mass) – सक्रिय द्रव्यमान का अर्थ मोलर सान्द्रता से होता है जिसे मोलरता भी कहा जाता है। किसी पदार्थ के एक लीटर आयतन में उपस्थित, मोलों की संख्या को उसका सक्रिय द्रव्यमान या मोलरता कहा जाता है।
सक्रिय द्रव्यमान = पदार्थ के मोल/आयतन लीटर में
उदाहरण के लिये A की मोलर सांद्रता को [A] में व्यक्त करेंगे।
साम्य स्थिरांक की गणना
माना कि एक सरल उत्क्रमणीय अभिक्रिया है।
aA+bB ⇌ cC+dD (एक निश्चित ताप पर)
द्रव्यानुपाती क्रिया के नियम के अनुसार :-
अग्र अभिक्रिया की दर ∝ [A]a[B]b = kf [A]a[B]b
पश्च अभिक्रिया की दर ∝ [C]c[D]d = kb [C]c[D]d
साम्य पर, पश्च अभिक्रिया की दर = अग्र अभिक्रिया की दर
k_f [A]^a[B]^b = k_b [C]^c[D]^d
\frac{kf}{kb} =k_c = \frac{[A]^a[B]^b}{[C]^c[D]^d}जहाँ Kcसाम्य स्थिरांक है
आंशिक दाब के संदर्भ में साम्य स्थिरांक Kp द्वारा प्रदर्शित किया जाता है एवं
k_p=\frac{P_C^cP_D^d}{P_A^aP_B^b}मोल प्रभाज के संदर्भ में, साम्य स्थिरांक Kx द्वारा प्रदर्शित किया जाता है एवं
k_x=\frac{X_C^c X_D^d}{X_A^a X_B^b}Kc , Kp एवं Kx के बीच सम्बन्ध
Kp = Kc(RT)△n
Kp = Kx (P)△n
△n = गैसीय उत्पाद के मोलो की संख्या – रासायनिक समीकरण में गैसीय अभिकारको के मोलो की संख्या
साम्य स्थिरांक की विशेषताएँ
- साम्य स्थिरांक का मान अभिकारकों की मूल सांद्रताओं से स्वतंत्र होता है।
- प्रत्येक अभिक्रिया के लिए निश्चित ताप पर साम्य स्थिरांक का निश्चित मान होता है जबकि ताप में परिवर्तन के साथ यह परिवर्तित होता है ।
- उत्क्रमणीय अभिक्रिया में प्रतीप अभिक्रिया के लिए साम्य स्थिरांक अग्र अभिक्रिया के लिए साम्य स्थिरांक के, व्युत्क्रमानुपाती होता है।
- साम्य स्थिरांक की सहायता से यह पता चलता है कि अभिक्रिया अग्र या प्रतीप दिशा में किस सीमा तक होती है।
- साम्य स्थिरांक उत्प्रेरक की उपस्थिति से स्वतंत्र होता है। ऐसा इसलिए होता है क्योंकि उत्प्रेरक अग्र तथा प्रतीप दोनों अभिक्रियाओं को समान रूप से प्रभावित करता है।
साम्य स्थिरांक के अनुप्रयोग
अभिक्रिया की सीमा ज्ञात करना :-
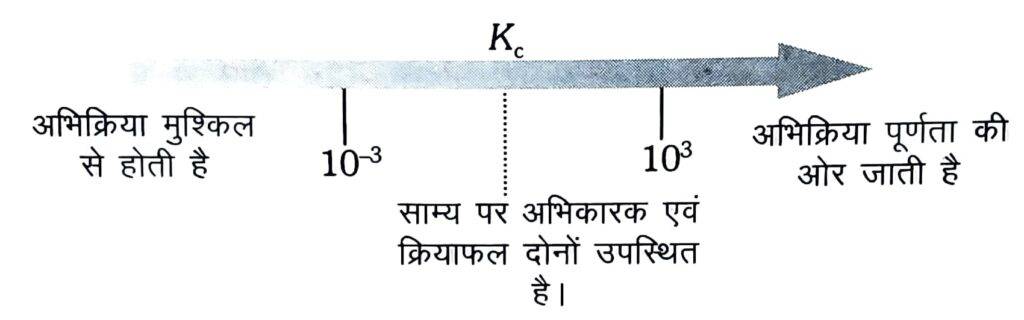
- यदि K > 103 तब उत्पाद अभिकारक से अधिकता में होगा। यदि K बहुत अधिक है, अभिक्रिया सभी दिशाओं में पूर्ण होगी।
- यदि K < 10-3 तब अभिकारक, उत्पाद से अधिकता में होगा। यदि Kc बहुत कम है, अभिक्रिया बहुत मुश्किल से होगी।
- यदि Kc 10-3से 103 की सीमा में है तब अभिकारक और उत्पाद दोनों की अधिक सांद्रता उपस्थित होगी ।
सांद्रता गुणांक और अभिक्रिया की दिशा ज्ञात करना :-
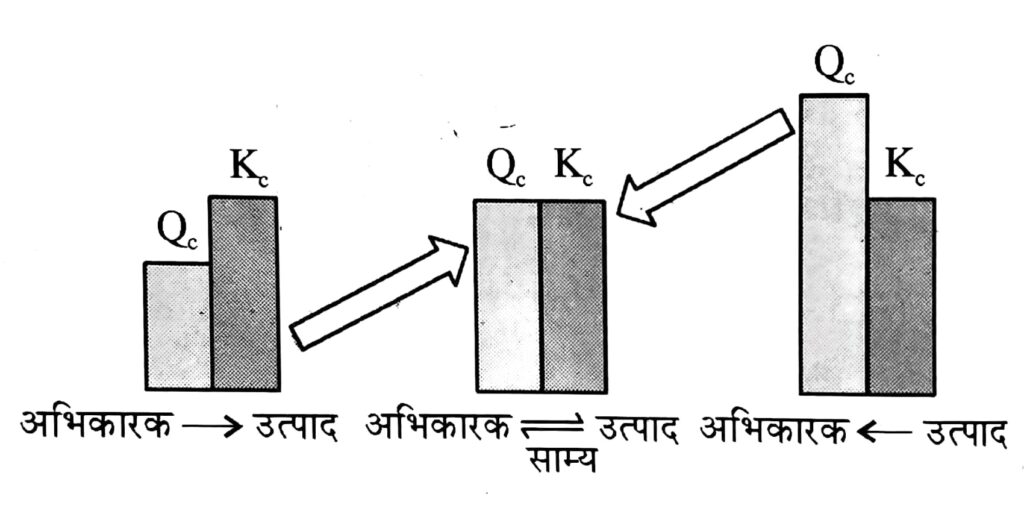
सांद्रता अनुपात अर्थात् अभिकारक और उत्पाद की सांद्रताओं के अनुपात को सांद्रता गुणांक कहते हैं, और इसे Q से प्रदर्शित करते हैं।
A+B ⇌ C+D
सांद्रता गुणांक,
Q =\frac{[C][D]}{[A][B]}जब अभिक्रिया साम्यावस्था पर होती है, Q साम्य स्थिरांक (K) के बराबर हो जाता है। साम्यावस्था पर Q=K= Kc = Kp इसलिए,
- यदि Q > K अभिक्रिया अभिकारकों की दिशा में होगी (विपरीत अभिक्रिया)
- यदि Q < K, अभिक्रिया उत्पाद की दिशा में होगी (अग्र अभिक्रिया)
- यदि Q = K, अभिक्रिया मिश्रण साम्यावस्था पर है । अर्थात् यदि Q < K तो अभिक्रिया में उत्पाद बनाने की प्रवृत्ति होगी और यदि Q> K तो अभिकारक बनाने की प्रवृत्ति होगी ।