हाइड्रोजन परमाणु स्पेक्ट्रम क्या है ? यहाँ Hydrogen Spectrum in Hindi हाइड्रोजन परमाणु स्पेक्ट्रम क्या है? से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
इस आर्टिकल में हाइड्रोजन स्पेक्ट्रम क्या होता है ? हाइड्रोजन परमाणु स्पेक्ट्रम इन विभिन्न श्रेणियों की रेखाओं की तंरगदैर्ध्य हाइड्रोजन स्पेक्ट्रम Hydrogen Spectrum in Hindi ,परमाणु स्पेक्ट्रम क्या है ? जैसे सभी महत्वपूर्ण टॉपिक को समावेश किया है
हाइड्रोजन स्पेक्ट्रम क्या होता है ?
यदि विसर्जन नली में हाइड्रोजन गैस लेकर निम्न दाब के अन्तर्गत उसमें से विद्युत प्रवाहित की जाये तथा उत्सर्जित (लाल रंग) किरण का स्पेक्ट्रोग्राफ की सहायता से विश्लेषण किया जाये तो UV , दृश्य तथा IR क्षेत्रों में तीव्र रेखाओं की श्रेणियों से बना स्पेक्ट्रम पाया जाता है ।
रेखाओं की यह श्रेणियाँ हाइड्रोजन का रैखिक या परमाणु स्पेक्ट्रम कहलाती हैं । दृश्य क्षेत्र में रेखायें फोटोग्राफिक पर्दे पर प्रत्यक्ष देखी जा सकती हैं ।
👉हाइड्रोजन स्पेक्ट्रम रैखिक उत्सर्जन स्पेक्ट्रम और परमाणु उत्सर्जन स्पेक्ट्रम अथवा असतत् स्पेक्ट्रम का उदाहरण है।
👉यह प्रकाश विभिन्न विलगित तीव्र रेखाओं का असतत् रेखीय वर्णक्रम दर्शाता है ।
👉स्पेक्ट्रम की प्रत्येक रेखा निश्चित तरंगदैर्ध्य के प्रकाश के अनुरूप होती है । सम्पूर्ण स्पेक्ट्रम रेखाओं का बना होता है , प्रत्येक श्रेणी को उसके खोजकर्ता के नाम पर नाम दिया गया है ।
हाइड्रोजन स्पेक्ट्रम ( Hydrogen Spectrum ) परमाणु स्पेक्ट्रम :
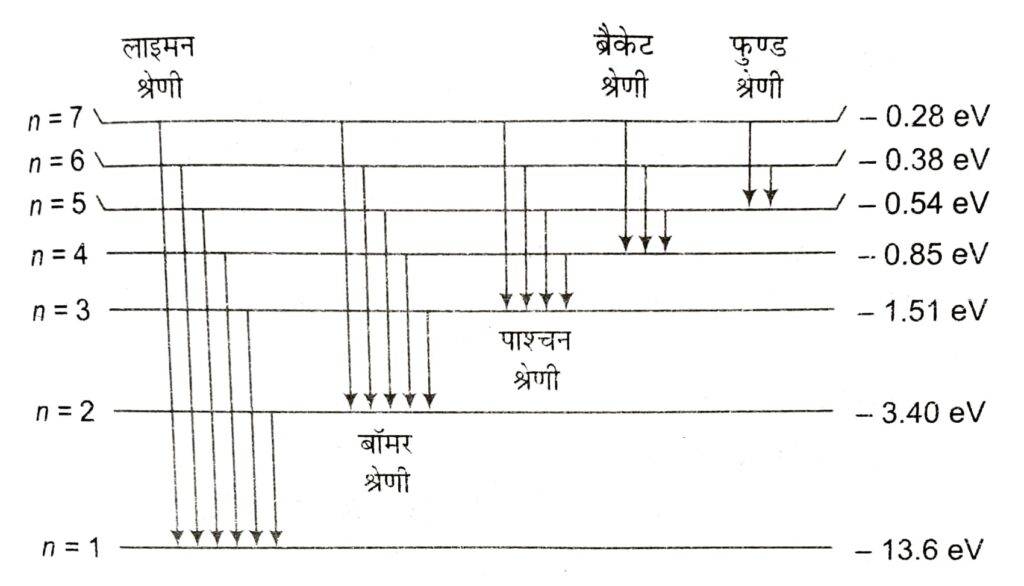
बोहर ने हाइड्रोजन के स्पेक्ट्रम का अध्ययन किया । इस स्पेक्ट्रम में काली पृष्ठभूमि पर पृथक् – पृथक् चमकीली रेखायें होती हैं । इन रेखाओं को Halpha , Hbeta , Hgamma , Hdelta , …कहते हैं ।
बॉमर ने सन् 1885 में यह ज्ञात किया कि बॉमर श्रेणी की सभी रेखाओं की तरंगदैर्ध्य ( λ ) =
\frac{1}{\lambda}=R(\frac{1}{{2}^2}-\frac{1}{{n_2}^2})
{n_2}=3,4,5...इस सूत्र द्वारा प्रदर्शित रेखाओं को बॉमर श्रेणी कहते हैं जहाँ R एक नियतांक है जिसे ‘ रिडबर्ग का नियतांक ‘ कहते हैं तथा इसका मान 1.097×107 प्रति मीटर है ।
बॉमर श्रेणी की कई रेखायें स्पेक्ट्रम के दृश्य भाग में होती हैं ।
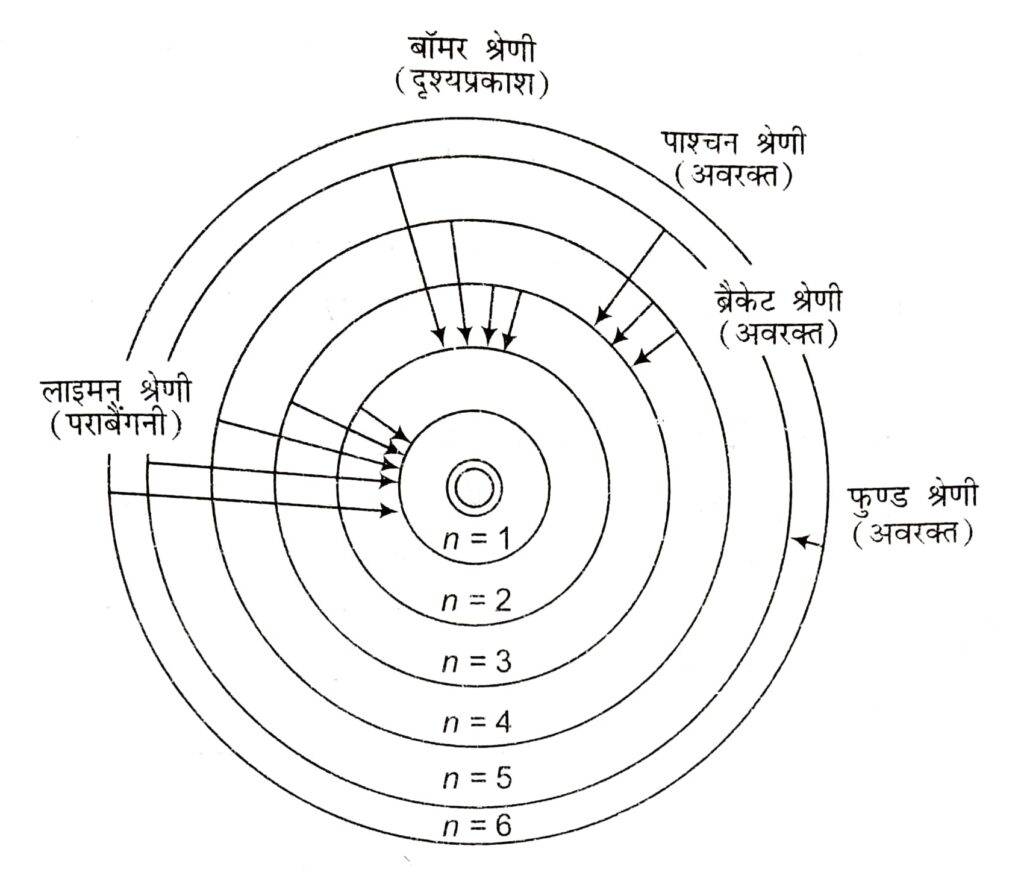
स्पेक्ट्रम के अदृश्य भाग में भी अन्य श्रेणियाँ प्राप्त की गई हैं जैसे लाइमन श्रेणी पराबैंगनी भाग में तथा पाश्चन , ब्रैकेट व फुण्ड श्रेणियाँ अवरक्त भाग में प्राप्त हुईं ।
| श्रेणी | n1 | n2 | स्पेक्ट्रम क्षेत्र | तंरगदैर्ध्य |
| लाइमन | 1 | 2,3 … | पराबैंगनी | < 4000 Å |
| बॉमर | 2 | 3,4 … | दृश्य | 4000 Å – 7000 Å |
| पाश्चन | 3 | 4,5 … | अवरक्त | >7000 Å |
| ब्रैकेट | 4 | 5,6 … | अवरक्त | >7000 Å |
| फुण्ड | 5 | 6,7 … | अवरक्त | >7000Å |
इन विभिन्न श्रेणियों की रेखाओं की तंरगदैर्ध्य :
(i) लाइमन श्रेणी (Lyman Series) n1=1 के लिए (पराबैंगनी क्षेत्र)
\frac{1}{\lambda}=R\left[\frac{1}{1^{2}}-\frac{1}{n_{2}^{2}}\right]जहाँ n2=2,3,4, …
(ii) बॉमर श्रेणी (Balmer Series) n1=2 के लिए (दृश्य क्षेत्र) :
\frac{1}{\lambda}=R\left[\frac{1}{2^{2}}-\frac{1}{n_{2}^{2}}\right] जहाँ n2=3,4, …
(iii) पाश्चन श्रेणी (Paschen Series) n1=3 के लिए (अवरक्त क्षेत्र)
\frac{1}{\lambda}=R\left[\frac{1}{3^{2}}-\frac{1}{n_{2}^{2}}\right]जहाँ n2=4,5,6, …
(iv) ब्रैकेट श्रेणी (Brackett Series) n1=4 के लिए (अवरक्त क्षेत्र) :
\frac{1}{\lambda}=R\left[\frac{1}{4^{2}}-\frac{1}{n_{2}^{2}}\right] जहाँ n2=5,6,7, …
(v) फुण्ड श्रेणी (Pfund Series) n1=5 के लिए (अवरक्त क्षेत्र) :
\frac{1}{\lambda}=R\left[\frac{1}{5^{2}}-\frac{1}{n_{2}^{2}}\right]जहाँ n2=6,7,8, …
हाइड्रोजन का रेखीय स्पेक्ट्रम सभी तत्वों के रेखीय स्पेक्ट्रम की तुलना में सबसे सरल होता है भारी परमाणुओं कार्य के स्पेक्ट्रम अपेक्षाकृत अधिक जटिल होता है परंतु सभी तत्वों केरेखीय स्पेक्ट्रम के कुछ गुण समान होते हैं
जैसे : प्रत्येक तत्व का रेखीय स्पेक्ट्रम विशिष्ट होता है प्रत्येक तत्व के रेखीय स्पेक्ट्रम में नियमितता पाई जाती है
