रदरफोर्ड का परमाणु मॉडल रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग दोष कमियां इस आर्टिकल में रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग रदरफोर्ड का परमाणु मॉडल से सम्बंधित परिभाषाये , alpha -कण का प्रकीर्णन प्रयोग (Scattering of alpha -particle) रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग क्या था और उन्होंने क्या निष्कर्ष निकाला रदरफोर्ड परमाणु मॉडल के दोष कमियां , रदरफोर्ड परमाणु मॉडल से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग क्या था ? और उन्होंने क्या निष्कर्ष निकाला।
रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग
रदरफोर्ड / गीगर एवं मार्सडन ( रदरफोर्ड के छात्र ) ने सोने की बहुत पतली पन्नी पर एक रेडियोएक्टिव स्रोत (लैड बॉक्स में रखा रेडियम) की सहायता से उच्च ऊर्जा युक्त α-कणों की बौछार की। इस पन्नी के आसपास जिंक सल्फाइड (ZnS) से बना एक वृत्ताकार प्रतिदीप्तिशील पर्दा होता है। जब कोई अल्फा कण इस पर्दे से टकराता है तो उस बिन्दु पर प्रकाश की स्फुरक्षणीदीप्ति या प्रतिदीप्ति (flash) उत्पन्न होती है।
इनके प्रकीर्णन को विश्लेषित करके निम्न प्रेक्षण प्राप्त किए :-
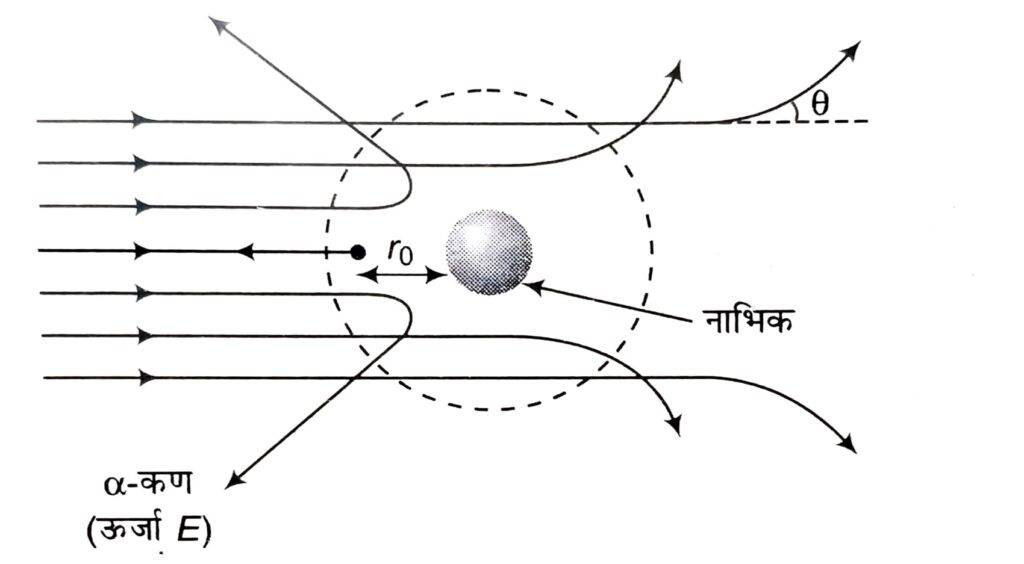
- अधिकांश -कण पन्नी से सीधे गुजर जाते हैं ।
- कुछ कण अल्प कोण से विचलित होते हैं ।
- बहुत ही कम कण ( 2000 में 1 ) सीधे वापस लौट आते हैं अर्थात् 180° के कोण से विचलित होते हैं ।
लक्ष्य द्वारा θ कोण पर प्रकीर्णित alpha कणों की संख्या :
N_{\theta}=\frac{N_{0} n t\left(2 Z e^{2}\right)}{4\left(4 \pi \varepsilon_{0}\right)^{2} r^{2}\left(m v_{0}^{2}\right)^{2}} \times \frac{1}{\sin ^{4}(\theta / 2)}जहाँ
Nθ= प्रकीर्णक के एकांक क्षेत्रफल पर टकराने वाले alpha कणों की संख्या;
n= प्रति मीटर3 पर लक्ष्य परमाणुओं की संख्या; t= लक्ष्य की मोटाई;
Ze= लक्ष्य नाभिक का आवेश;
2e=alpha -कण पर आवेश;
r= लक्य से पदें की दूरी ;
v0= निकटतम उपगमन की दूरी पर alpha -कण का वेग।
👉नाभिक के केन्द्र से वह न्यूनतम दूरी जहाँ तक -कण पहुँचता है निकटतम पहुँच दूरी r0 (उपगमन की दूरी) कहलाती है । इस दूरी पर alpha कण की सम्पूर्ण गतिज ऊर्जा का स्थितिज ऊर्जा में परिवर्तन हो जाता है
अत : निकटतम उपगमन की दूरी
r_{0}=\frac{1}{4 \pi \varepsilon_{0}} \frac{2 Z e^{2}}{E_{k}}जहाँ Ek, आपतित कण की गतिज ऊर्जा है।
Read more: [NCERT] कक्षा 11 भौतिक विज्ञान नोट्स
Read more: [NCERT] कक्षा 12th भौतिक विज्ञान नोट्स
रदरफोर्ड का परमाणु मॉडल
alpha कण के प्रकीर्णन के प्रयोगों के निष्कर्षों के आधार पर रदरफोर्ड ने एक मॉडल दिया, जिसे रदरफोर्ड परमाणु मॉडल कहते हैं। इस मॉडल के अनुसार,
- परमाणु के केन्द्र पर लगभग 10-15 m त्रिज्या का नाभिक होता है जिसमें परमाणु का समस्त घनात्मक आवेश तथा द्रव्यमान केन्द्रित होता है। नाभिक पर +Ze आवेश होता है, जहाँ Z अवयव का परमाणु क्रमांक है।
- रदरफोर्ड ने गणना करके बताया कि नाभिक का आयतन, परमाणु के कुल आयतन की तुलना में बहुत कम होता है। परमाणु की त्रिज्या लगभग 10-10 m होती है, जबकि नाभिक की त्रिज्या लगभग 10-15 m होती है
- इलेक्ट्रॉन (ऋणात्मक आवेशित कण) लगभग 10-10 m त्रिज्या के खोखले गोले के भीतर बँटे रहते हैं।
- इलेक्ट्रानों का कुल ऋणात्मक आवेश नाभिक के धनात्मक आवेश के बराबर होता है।
- इलेक्ट्रॉन, नाभिक के चारों और स्थिर नहीं रहते हैं, अन्यथा नाभिक के धनात्मक आवेश के आकर्षण के कारण इलेक्ट्रॉन नाभिक में गिर जाते तथा परमाणु अस्थायी हो जाता। अत: रदरफोर्ड ने माना कि इलेक्ट्रॉन नाभिक के चारों ओर वृत्तीय कक्षाओं में घूमते है।
- इलेक्ट्रॉन और नाभिक आपस में स्थिर वैद्युत् आकर्षण बलों के द्वारा बँधे रहते हैं।
रदरफोर्ड के परमाणु मॉडल की क्या सीमाएं हैं?
रदरफोर्ड परमाणु मॉडल के दोष कमियां :
- परमाणु स्थायित्व : यह मॉडल परमाणु के स्थायित्व को नहीं समझा सका , क्योंकि विद्युत – चुम्बकत्व के सिद्धान्त के अनुसार एक त्वरित आवेश ऊर्जा उत्सर्जित करता है ।
अत : वृत्तीय कक्षाओं में घूम रहे इलेक्ट्रॉन भी ऊर्जा उत्सर्जित करेंगे और इलेक्ट्रॉन धीरे – धीरे अपनी ऊर्जा खो देगा अर्थात् इनके वृत्तीय कक्षा की त्रिज्या कम होती जाएगी और अन्ततः इलेक्ट्रॉन नाभिक में गिर जाएगा ।

- इस मॉडल के आधार पर परमाणु का स्पेक्ट्रम सतत् होना चाहिए परन्तु व्यवहारिक रूप से रेखीय स्पेक्ट्रम ( असतत् ) प्राप्त होता है ।
- यह नाभिक के चारों ओर इलेक्ट्रॉन वितरण को न समझा सका ।
