यहाँ लुईस प्रतीक किसे कहते हैं अणुओं का लूइस बिंदु निरूपण इलेक्ट्रॉन बिंदु संरचना कैसे बनाते हैं? से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
लूइस प्रतीक ( Lewis Symbols )
अणु बनते समय परमाणु के केवल बाह्यतम कोश के इलेक्ट्रॉन ही भाग लेते हैं । इन्हें संयोजी इलेक्ट्रॉन या संयोजकता इलेक्ट्रॉन ( Valence Electron ) कहते हैं ।
लुईस प्रतीक किसे कहते हैं ?
लूइस के परमाणुओं के संयोजकता इलेक्ट्रॉनों को प्रदर्शित करने के लिए दिए गए सरल संकेत को लूइस प्रतीक कहते हैं , जिसमें बाह्यतम कोश के इलेक्ट्रॉनों को तत्त्व के संकेत के चारों ओर बिन्दुओं द्वारा दर्शाया जाता है ।
द्वितीय आवर्त के तत्त्वों के लूइस प्रतीक इस प्रकार दिए जाते हैं ।
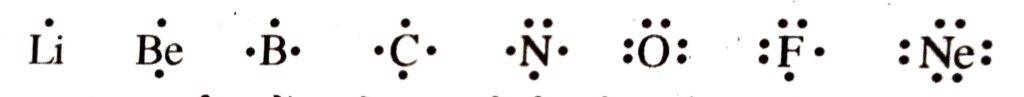
लूइस प्रतीक में उपस्थित संयोजी इलेक्ट्रॉनों की सहायता से तत्त्व की सामान्य या समूह ( वर्ग ) संयोजकता ज्ञात की जाती है ।
तत्त्वों की समूह संयोजकता लूइस प्रतीक में उपस्थित इलेक्ट्रॉनों ( बिन्दुओं ) की संख्या या 8 में से संयोजकता इलेक्ट्रॉनों की संख्या घटाने से प्राप्त संख्या के बराबर होती है ।
सरल अणुओं का लूइस निरूपण ( लुईस बिंदु संरचना)
[ Lewis Representation of Simple molecules ( Lewis structures ) ]
सहसंयोजी बन्ध युक्त अणुओं व आयनों में , अष्टक नियम के अनुसार बन्धन तथा सहभाजित इलेक्ट्रॉन युग्मों को बिन्दुओं द्वारा दर्शाने से प्राप्त संरचना को लूइस संरचना कहते हैं ।
लूइस संरचना पर अणु का विरचन तथा उसके गुणों की व्याख्या की जा सकती है ।
किसी अणु की लूइस संरचना ,इलेक्ट्रॉन बिंदु संरचना लिखने के लिए आवश्यक पद
- लूइस संरचना लिखने के लिए सर्वप्रथम आवश्यक कुल इलेक्ट्रॉनों की संख्या संयुक्त होने वाले परमाणुओं के संयोजी इलेक्ट्रॉनों के योग के बराबर होती है , को ज्ञात कर लेते हैं । जैसे- CH4 , में कुल संयोजकता इलेक्ट्रॉन 8 ( 4 कार्बन परमाणु से तथा 4 हाइड्रोजन परमाणुओं से ) होते हैं ।
- संयोजकता इलेक्ट्रॉनों की कुल संख्या में ऋणायनों के लिए प्रति ऋणावेश एक इलेक्ट्रॉन जोड़ देते हैं , जबकि धनायनों के लिए प्रति धनावेश एक इलेक्ट्रॉन घटा देते हैं ।
जैसे CO32- : – में संयोजी इलेक्ट्रॉनों की संख्या = C + 3 x [ 0 ] + 2 = 4 + 3 x [ 6 ] + 2 = 24 तथा NH4+ ; में संयोजी इलेक्ट्रॉनों की संख्या = N + 4 x [ H ]-1 = 5 + 4 x 1-1 = 8 - संयुक्त होने वाले परमाणुओं के प्रतीकों तथा अणु की संरचना का ज्ञान होने पर अर्थात् कौनसे परमाणु किन परमाणुओं के साथ बन्ध बनाते हैं , परमाणुओं के बीच सभी इलेक्ट्रॉनों को , बंधित सहभाजी इलेक्ट्रॉन युग्मों के रूप में कुल आबंधों की संख्या के अनुपात में वितरित करना सरल हो जाता है ।
- सामान्यतः अणु में न्यूनतम विद्युत ऋणात्मकता वाला परमाणु केन्द्रीय परमाणु होता है । हाइड्रोजन तथा फ्लुओरीन के परमाणु अंतस्थ स्थान पर होते हैं । जैसे NF3 तथा CO32- में क्रमश : नाइट्रोजन तथा कार्बन केन्द्रीय परमाणु हैं ।
- अन्त में एकल बन्धों के लिए साझित इलेक्ट्रॉन युग्म लिखने के पश्चात् शेष बचे इलेक्ट्रॉन युग्मों को या तो बहु आबन्ध के लिए प्रयुक्त किया जाता है या वे एकाकी इलेक्ट्रॉन युग्मों के रूप में उपस्थित रहते हैं ।
लेकिन यहाँ मुख्य बात यह है कि सभी बन्धित परमाणुओं का अष्टक पूर्ण हो जाना चाहिए । लेकिन हाइड्रोजन का द्विक पूर्ण होता है अर्थात् यह हीलियम के समान विन्यास प्राप्त करता है ।
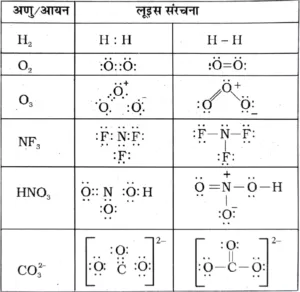
H2 , O2 , NF3 , HNO3 , CO32- अणुओं तथा आयनों की लुईस बिंदु संरचना

Thankyou sir i am so happy 🥰 Concept clear nice 😊
thanks
अगर मुझे I आयोडीन को लूईस प्रतीक के रूप में लिखना हो तो कैसे लिखें,,,, बताइये