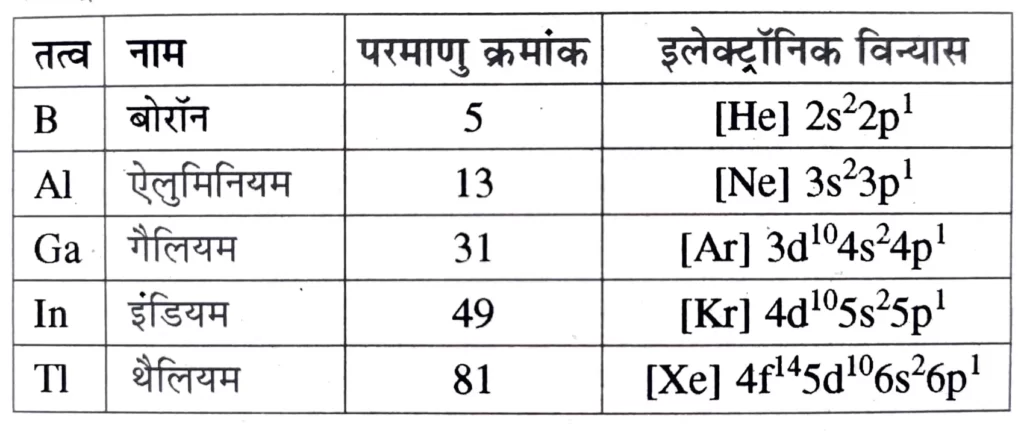
वर्ग-13 के तत्त्व : बोरॉन परिवार [ The Boron Family ]से संबंधित सभी महत्वपूर्ण जानकारी दी गई है। समूह -13 के तत्त्व : बोरॉन परिवार ( Group – 13 Elements : The Boron Family ) आवर्त सारणी के 13 वें वर्ग के तत्त्व बोरॉन ( B ) , ऐलुमिनियम ( Al ) , गैलियम ( Ga ) , इंडियम ( In ) तथा थैलियम ( Tl ) हैं ।
इनमें से बोरॉन अधातु है जबकि अन्य सभी तत्त्व धातु हैं ।
प्राप्ति – : बोरॉन एक दुर्लभ तत्व है । यह मुख्य रूप से आर्थोबोरिक अम्ल ( H3BO3 ) , बोरेक्स (Na2B4O7.10H2O) तथा करनाइट( Na2B4O7 . 4H2O ) के रूप में मिलता है ।
ऐलुमिनियम की भू – पर्पटी में बाहुल्यता सर्वाधिक ( 8.3 % ) होती है । ऐलुमिनियम के प्रमुख अयस्क बॉक्साइट ( Al2O3.2H2O ) तथा क्रायोलाइट ( Na3AlF6 ) हैं ।
गैलियम , इंडियम तथा थैलियम प्रकृति में बहुत कम मात्रा में पाए जाते हैं ।
इलेक्ट्रॉनिक विन्यास
समूह 13 के तत्वों का बाह्यतम ( संयोजकता कोश ) इलेक्ट्रॉनिक विन्यास ns2np1 है । यहाँ n = 2 से 6.
परमाणु त्रिज्या ( Atomic Radius )
वर्ग में ऊपर से नीचे जाने पर परमाणु त्रिज्या में वृद्धि होती है । क्योंकि प्रत्येक क्रमागत सदस्य में इलेक्ट्रॉनों का एक कोश जुड़ता है ।
Ga की परमाणु त्रिज्या AI की परमाणु त्रिज्या से कुछ कम होती है क्योंकि इसमें 10 इलेक्ट्रॉन आन्तरिक d कक्षकों में भरे जाते हैं जिनका परिरक्षण प्रभाव बढ़े हुए नाभिकीय आवेश की तुलना में कम होता है । अतः नाभिकीय आकर्षण बल बढ़ जाता है , इसलिए त्रिज्या में कमी हो जाती है ।
13 वें समूह के तत्वों की परमाणु त्रिज्या का क्रम — B < Ga < Al < In < Tl
आयनन एन्थैल्पी ( Ionizations Enthalpy )
सामान्यतः वर्ग में परमाणु आकार बढ़ने के साथ आयनन एन्थैल्पी कम होती है लेकिन 13 वें समूह में यह क्रम नियमित नहीं है ।
- Ga की आयनन एन्थैल्पी AI की आयनन एन्थैल्पी से अधिक होती है क्योंकि Ga में आन्तरिक d कक्षकों में 10 इलेक्ट्रॉन भरे जाते हैं । जिनका परिरक्षण प्रभाव दुर्बल होता है तथा नाभिकीय आवेश में वृद्धि भी अधिक होती है । इस कारण Ga में से इलेक्ट्रॉन को निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है ।
- Tl की आयनन एन्थैल्पी , In की आयनन एन्थैल्पी से अधिक होती है क्योंकि In से Tl पर जाने पर आन्तरिक 4f कक्षकों में 14 इलेक्ट्रॉन भरे जाते हैं , जिनके द्वारा बाह्य इलेक्ट्रॉनों का नाभिकीय आकर्षण से प्रभावी परिरक्षण नहीं हो पाता है तथा नाभिकीय आवेश में वृद्धि भी अधिक होती है । अतः प्रभावी नाभिकीय आवेश बढ़ जाता है इसलिए In की अपेक्षा Tl में से इलेक्ट्रॉन निकालना मुश्किल होता है ।
13 वें वर्ग के तत्वों की प्रथम आयनन एन्थैल्पी का क्रम – B > Al < Ga > In < Tl
13 वें समूह के सभी तत्वों के लिए प्रथम , द्वितीय तथा तृतीय आयनन एन्थैल्पी क्रमश : बढ़ती है जैसा कि सामान्यतः होता है ।
△iH1 , < △iH2 < △iH3
तथा प्रत्येक तत्व की तीन एन्थैल्पियों का योग उच्च होता है क्योंकि इनकी द्वितीय तथा तृतीय आयनन एन्थैल्पी का मान प्रथम आयनन एन्थैल्पी की अपेक्षा बहुत अधिक होता है जिसका कारण इलेक्ट्रॉनों का s कक्षकों में से निकलना है जिनकी भेदन क्षमता अधिक होती है ।
विद्युत ॠणता ( Electro Negativity )
B से Al तक विद्युत ॠणता कम होती है लेकिन Ga की विद्युत ऋणता AI से तथा Tl की विद्युत ॠणता In से कुछ अधिक होती है जिसका कारण नाभिकीय आकर्षण बल है जैसा कि आयनन एन्थैल्पी में होता है ।
बोरॉन परिवार के भौतिक गुण ( Physical Properties )
- बोरॉन काले रंग का अत्यधिक कठोर पदार्थ है जो कि अधातु होता है । इसमें अपररूपता का गुण पाया जाता है तथा इसकी विद्युत चालकता बहुत कम होती है ।
- एलुमिनियम रजत जैसी श्वेत , चमकीली धातु है जिसकी तनन सामर्थ्य वैद्युत एवं ऊष्मा चालकता उच्च होती है । वर्ग के अन्य तत्त्वों की चालकता भी उच्च होती है तथा ये मुलायम ठोस धातु होते हैं ।
- घनत्व – समूह 13 में तत्वों का घनत्व वर्ग में ऊपर – नीचे जाने पर बढ़ता है क्योंकि आयतन की तुलना में द्रव्यमान में वृद्धि अधिक होती है ।
- गलनांक तथा क्वथनांक– प्रबल क्रिस्टलीय जालक संरचना के कारण बोरॉन का गलनांक असाधारण रूप से उच्च होता है ।
B से Ga तक गलनांक में कमी होती है इसके पश्चात् वृद्धि होती है , लेकिन क्वथनांक के मान वर्ग में नियमित रूप से कम होते जाते हैं ।
गलनांक B >>> Al >> Ga < In < TI
क्वथनांक B > Al > Ga > In > TI - धात्विक गुण या विद्युत धनी गुण– B से Al तक धात्विक गुण बढ़ता है , इसके पश्चात Tl तक धात्विक गुण में कमी होती है । क्योंकि Al का आकार B से अधिक होता है अतः इसकी इलेक्ट्रॉन त्यागने की प्रवृत्ति अधिक होती है ।
बोरॉन परिवार के रासायनिक गुण ( Chemical Properties )
ऑक्सीकरण अवस्था ( Oxidation Stage )
बोरॉन के छोटे आकार के कारण इसकी प्रथम तीन आयनन एन्थैल्पियों का योग बहुत अधिक होता है । अतः यह +3 ऑक्सीकरण अवस्था ( B+3 ) नहीं दर्शाता है तथा सहसंयोजी यौगिक बनाता है । :
ऐलुमिनियम की प्रथम तीन आयनन एन्थैल्पियों का योग कम होने के कारण यह आसानी से Al3+ आयन बना लेता है ।
Ga , In तथा Tl भी +3 ऑक्सीकरण अवस्था दर्शाते हैं तथा इसके साथ ही ये +1 अवस्था भी दर्शाते हैं तथा वर्ग में नीचे जाने पर भारी तत्वों में +1 अवस्था का स्थायित्व बढ़ता जाता है , इसका कारण अक्रिय युग्म प्रभाव है । d तथा कक्षकों के दुर्बल परिरक्षण प्रभाव के कारण बढ़ा हुआ नाभिकीय आवेश ns इलेक्ट्रॉनों को प्रबलता से आकर्षित करता है जिससे कक्षक का इलेक्ट्रॉन युग्म निष्क्रिय हो जाता है , इसे अक्रिय युग्म प्रभाव कहते हैं ।
Tl में +1 ऑक्सीकरण अवस्था अधिक स्थायी होती है । जबकि Tl3+ प्रबल ऑक्सीकारक होता है अर्थात् इसमें इलेक्ट्रॉन ग्रहण करके +1 अवस्था में जाने की प्रवृत्ति होती है ।
NOTE – +1 क्सीकरण अवस्था वाले यौगिकों की आयनिक प्रकृति , +3 ऑक्सीकरण अवस्था वाले यौगिकों की तुलना में अधिक होती है ।
रासायनिक अभिक्रियाशीलता की प्रवृत्ति ( Tendency of Chemical Reactivity )
( i ) वर्ग 13 के तत्वों की त्रिसंयोजी अवस्था में केन्द्रीय परमाणु के चारों ओर 6 इलेक्ट्रॉन होते हैं , अतः ये इलेक्ट्रॉन न्यून यौगिक होते हैं । जैसे BF3 , BCl3 , इत्यादि में B पर इलेक्ट्रॉन की कमी के कारण ये लूइस अम्ल की भाँति व्यवहार करते हैं । अतः ये अमोनिया से एक एकाकी इलेक्ट्रॉन युग्म ग्रहण कर उपसहसंयोजक यौगिक बनाते हैं ।
( ii ) वर्ग में ऊपर से नीचे जाने पर आकार में वृद्धि होने के कारण इलेक्ट्रॉन युग्म ग्रहण करने की प्रवृत्ति कम होती है , अतः लूइस अम्ल गुण भी कम होता जाता है ।
( iii ) AlCl3 में द्विलक ( Dimer ) बनाने की प्रवृत्ति होती है । अतः यह Al2Cl6 , के रूप में पाया जाता है । लेकिन B के छोटे आकार के कारण BCl3 द्विलक नहीं बनाता है ।
वायु के प्रति अभिक्रियाशीलता ( Reactivity with Air ) – अक्रिस्टलीय B तथा Al को वायु के साथ गर्म करने पर ये O2 से क्रिया करके क्रमश : B2O3 तथा Al2O3 बनाते हैं । इसी प्रकार वर्ग के अन्य तत्व भी वायु की ऑक्सीजन के साथ क्रिया करके E2O3 प्रकार के ऑक्साइड बनाते हैं
2E (s) + 3O2 (g) → वायु → 2E2O3
13 वें वर्ग के सभी तत्व उच्च ताप पर नाइट्रोजन के साथ क्रिया करके नाइट्राइड बनाते हैं
2E (s) + N2 (g) → 2EN (s)
अम्लों तथा क्षारों के प्रति अभिक्रियाशीलता ( Reactivity with Acids and Bases ) – बोरॉन की अम्ल तथा क्षार के साथ कोई क्रिया नहीं होती है परन्तु ऐलुमिनियम खनिज अम्लों तथा जलीय क्षारों से क्रिया करके उनमें घुल जाता है , अतः यह उभयधर्मी होता है । यह तनु HCI से क्रिया करके हाइड्रोजन उत्सर्जित करता है ।
2Al (s) + 6HCl (aq) → 2Al3++ (aq) + 6Cl– (aq) + 3H2
सान्द्र नाइट्रिक अम्ल , ऐलुमिनियम की सतह पर ऑक्साइड की परत बनाकर उसे निष्क्रिय बना देता है । बोरॉन की तनु H2SO4 के साथ कोई क्रिया नहीं होती लेकिन ऐलुमिनियम तनु H2SO4 से क्रिया करके हाइड्रोजन गैस मुक्त करता है ।
2Al (s) + 3H2SO4 (aq)तनु → Al2(SO4)3 (aq) + 3H2 (g)
हैलोजनों के प्रति अभिक्रियाशीलता ( Reactivity with Halogens ) – वर्ग 13 के सभी तत्व हैलोजन से क्रिया करके ट्राइहैलाइड बनाते हैं लेकिन Tl , TlI3 , नहीं बनता है , जबकि यह TlX प्रकार के हैलाइड बनाता है ।
2E (s) + 3X2 (g) → 2EX3 (s) ( X = F , Cl , Br , I )
