वर्ग-14 के तत्त्व : कार्बन परिवार [The Carbon Family] से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
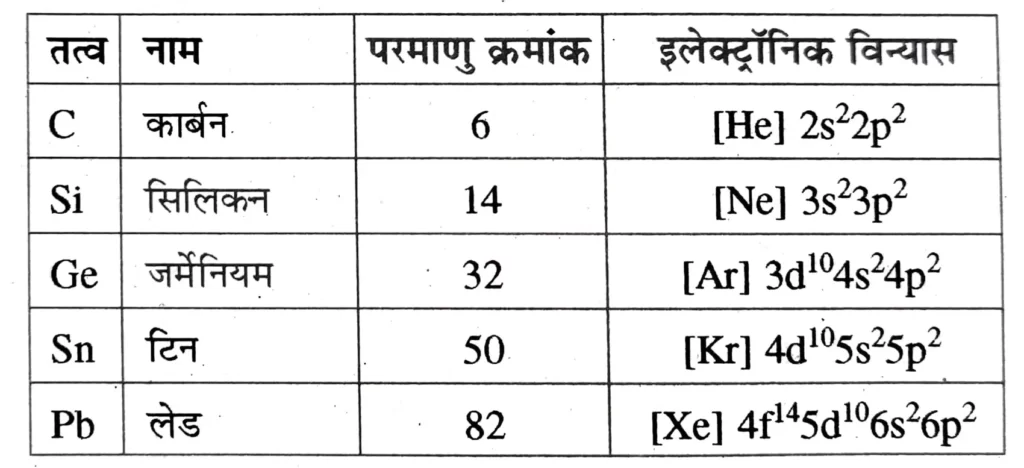
समूह -14 के तत्त्व : कार्बन परिवार ( Group – 14 Elements : The Carbon Family ) आवर्त सारणी के वर्ग 14 के तत्व – कार्बन ( C ) , सिलिकन ( Si ) , जर्मेनियम ( Ge ) , टिन ( Sn ) तथा लेड ( Pb ) ।
इनमें से कार्बन तथा सिलिकन अधातु , जर्मेनियम उपधातु एवं टिन तथा लैड धातु हैं ।
उपस्थिति ( Occurrence ) – कार्बन प्रकृति में स्वतंत्र तथा संयुक्त अवस्था में बहुतायत से उपलब्ध है । तत्व अवस्था में यह कोयला , ग्रेफाइट तथा हीरा में मिलता है , जबकि संयुक्त अवस्था में यह धातु कार्बोनेट , हाइड्रोकार्बन तथा वायु में कार्बन डाइऑक्साइड गैस ( 0.03 % आयतन से ) के रूप में पाया जाता है ।
सिलिकन भू – पर्पटी में बाहुल्यता में पाया जाने वाला ( 22.7 % भार से ) द्वितीय तत्व है । यह प्रकृति में सिलिका तथा सिलिकेट ( 95 % ) के रूप में पाया जाता है । सिलिकन , सिरेमिक , काँच तथा सीमेन्ट का महत्त्वपूर्ण घटक होता है ।
जर्मेनियम अति सूक्ष्म मात्रा में पाया जाता है ।
मुख्यतः टिन स्टोन , SnO2 ( केसिटेराइट ) से टिन तथा गैलेना ( PbS ) अयस्क से लेड प्राप्त किया जाता है ।
इलेक्ट्रॉनिक विन्यास ( Electronic Configuration )
समूह 14 के तत्वों का बाह्यतम ( संयोजकता कोश ) इलेक्ट्रॉनिक विन्यास ns2np2 होता है , यहाँ n = 2 से 6
परमाणु त्रिज्या ( Atomic Radius )
समूह 14 के तत्वों की परमाणु त्रिज्या समूह 13 के संगत तत्वों से कम होती है क्योंकि आवर्त में बाएँ से दाएँ जाने पर प्रभावी नाभिकीय है ।
आवेश बढ़ने के कारण इलेक्ट्रॉनों पर नाभिकीय आकर्षण बल बढ़ जाता वर्ग में ऊपर से नीचे जाने पर परमाणु त्रिज्या बढ़ती है क्योंकि कोशों की संख्या बढ़ने के कारण परिरक्षण प्रभाव बढ़ता है ।
C से Si तक परमाणु त्रिज्या में वृद्धि अधिक होती है , लेकिन इसके पश्चात् Si से Pb तक परमाणु त्रिज्या में वृद्धि कम होती है क्योंकि इन तत्वों में d तथा f कक्षकों में उपस्थित इलेक्ट्रॉनों का परिरक्षण प्रभाव कम होता है ।
आयनन एन्थैल्पी ( Ionization Enthalpy )
समूह 14 के तत्वों की प्रथम आयनन एन्थैल्पी , समूह 13 के संगत तत्वों की प्रथम आयनन एन्थैल्पी से अधिक होती है क्योंकि आवर्त में आकार में कमी होने के कारण परमाणु में से इलेक्ट्रॉन निकालना मुश्किल होता है ।
वर्ग में ऊपर से नीचे जाने पर आयनन एन्थैल्पी कम होती है । क्योंकि परमाणु आकार बढ़ने के कारण नाभिक से बाह्यतम इलेक्ट्रॉन के मध्य दूरी बढ़ती है जिससे इलेक्ट्रॉन को निकालना आसान हो जाता है ।
वर्ग 14 में C से Sn तक आयनन एन्थैल्पी कम होती है लेकिन Sn से Pb तक आयनन एन्थैल्पी में कुछ वृद्धि होती है क्योंकि नाभिकीय आवेश में वृद्धि अधिक होती है ( 32 का अन्तर ) तथा d व f इलेक्ट्रॉनों का परिरक्षण प्रभाव दुर्बल होता है अतः वर्ग 14 के तत्वों की प्रथम आयनन एन्थैल्पी का क्रम –
C > Si > Ge > Sn < Pb
विद्युतऋणता ( Electronegativity )
वर्ग में ऊपर से नीचे जाने पर C से Si तक विद्युतऋणता कम होती है , इसके पश्चात् Pb तक विद्युतऋणता लगभग समान रहती है ।
कार्बन परिवार के भौतिक गुणधर्म ( Physical Properties )
- समूह 14 के सभी तत्व ठोस होते हैं जिनमें से टिन तथा लेड कम गलनांकयुक्त मुलायम धातु है ।
- वर्ग में ऊपर से नीचे जाने पर घनत्व बढ़ता है क्योंकि आकार की तुलना में द्रव्यमान में वृद्धि अधिक होती है ।
- समूह 14 के तत्वों के गलनांक तथा क्वथनांक समूह 13 के संगत तत्वों की तुलना में बहुत अधिक होते हैं क्योंकि इनकी परमाणु त्रिज्या कम होती है । अतः अन्तरा परमाण्विक आकर्षण बढ़ जाता है ।
- वर्ग में ऊपर से नीचे जाने पर गलनांक तथा क्वथनांक के मान सामान्यतः कम होते हैं क्योंकि परमाणु आकार बढ़ने के कारण अन्तरा – परमाण्विक आकर्षण कम हो जाता है ।
कार्बन परिवार के रासायनिक गुणधर्म ( Chemical Properties )
ऑक्सीकरण अवस्था ( Oxidation State )
समूह 14 के तत्वों के संयोजी कोश में 4 इलेक्ट्रॉन होते हैं अतः ये +4 ऑक्सीकरण अवस्था दर्शाते हैं लेकिन इनमें +4 के अतिरिक्त +2 ऑक्सीकरण अवस्था दर्शाने की प्रवृत्ति भी होती है तथा कार्बन ऋणात्मक ऑक्सीकरण अवस्था भी प्रदर्शित करता है ।
इस समूह के भारी तत्वों में , Ge < Sn < Pb क्रम में +2 ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति बढ़ती जाती है , क्योंकि संयोजकता कोश के ns2 इलेक्ट्रॉन बंधन में भाग नहीं लेते हैं अर्थात् यहाँ भी अक्रिय युग्म प्रभाव लागू होता है । इन दो ऑक्सीकरण अवस्थाओं का आपेक्षिक स्थायित्व वर्ग में परिवर्तित होता है ।
रासायनिक अभिक्रियाशीलता की प्रवृत्ति ( Tendency of Chemical Reactivity ) –
CCl4 का जल अपघटन नहीं होता है जबकि SiCl4 का जल अपघटन होता है क्योंकि Si के पास रिक्त d- कक्षक होते हैं ।
वर्ग 14 के तत्व दो प्रकार के ऑक्साइड बनाते हैं MO ( मोनोऑक्साइड ) तथा MO2 ( डाइऑक्साइड ) ।
CO2 गैस है जबकि SiO2 ठोस है क्योंकि CO2 एक विविक्त अणु है , लेकिन SiO2 की दीर्घ जटिल संरचना होती है।
वर्ग में ऑक्साइडों का अम्लीय गुण कम होता है अतः CO2 , SiO2 तथा GeO2 अम्लीय है जबकि SnO2 तथा PbO2 उभयधर्मी हैं ।
कार्बन वर्ग के तत्व दो प्रकार के हैलाइड बनाते हैं MX2 तथा MX4 लेकिन वर्ग में नीचे जाने पर MX2 बनाने की प्रवृत्ति बढ़ती है ।
