रासायनिक आबंधन -हाइड्रोजन बन्ध ( Hydrogen bonding ) से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
- हाइड्रोजन बन्ध ( Hydrogen bonding )
- हाइड्रोजन आबंध बनने का कारण
- हाइड्रोजन बन्धन का प्रकार
- हाइड्रोजन आबंध के गुण
- हाइड्रोजन बन्ध का यौगिकों के गुणों पर प्रभाव
जैसे महत्वपूर्ण टॉपिक से संबंधित सभी महत्वपूर्ण जानकारी है।
सन् 1920 में लेटीमर ( Latimer ) और रोडेबुश ( Rodebush ) ने हाइड्रोजन बन्ध का विचार प्रस्तावित किया । हाइड्रोजन बन्धन के निर्माण के लिये अणु में हाइड्रोजन परमाणु से बन्धन के लिये F , O अथवा N जैसा उच्च ऋणविद्युती परमाणु होना चाहिये एवं ऋणविद्युती परमाणु का आकार अत्यन्त छोटा होना चाहिये ।
हाइड्रोजन बन्ध ( Hydrogen bonding )
हाइड्रोजन बन्ध के बारे में सर्वप्रथम लेटिमर तथा रोडबुश ने बताय था ध्रुवीय अणुओं जिनमें हाइड्रोजन के साथ अधिक विद्युत ऋणी तत्त्व ( नाइट्रोजन , ऑक्सीजन या फ्लुओरीन ) जुड़े होते हैं तो बन्ध में ध्रुवता आ जाती है ।
ध्रुवीय अणुओं में एक अणु का आंशिक धनावेशित हाइड्रोजन परमाणु , दूसरे अणु के आंशिक ऋणावेशित परमाणु को स्थिर वैद्युत बल द्वारा आकर्षित करता है इस आकर्षण बल को ही हाइड्रोजन-बन्ध कहते हैं ।
जैसे HF में हाइड्रोजन बन्ध को निम्न प्रकार दर्शाया जाता है-
……Hδ+−Fδ−
अत : हाइड्रोजन आबंध वह आकर्षण बल है जो एक अणु के हाइड्रोजन परमाणु को दूसरे अणु के विद्युत ऋणी परमाणु ( F O या N ) से जोड़ता है ।
हाइड्रोजन आबंध बनने का कारण
( Cause of Formation of Hydrogen Bond )
जब हाइड्रोजन परमाणु किसी प्रबल विद्युत ऋणी तत्त्व ‘ X ‘ से बंधित होता है , तो साझित इलेक्ट्रॉन युग्म हाइड्रोजन परमाणु से दूर हो है ।
जिससे हाइड्रोजन परमाणु दूसरे परमाणु ( ‘ X ‘ ) के सापेक्ष अधिक विद्युत धनात्मक हो जाता है । चूँकि इलेक्ट्रॉन ‘ X ‘ परमाणु की ओर स्थानान्तरित हो जाते हैं , इसलिए हाइड्रोजन परमाणु आंशिक धनावेश ( δ+ ) ग्रहण करता है , जबकि X परमाणु पर आंशिक ऋणावेश ( δ- ) आ जाता है । इससे एक ध्रुवीय अणु प्राप्त होता है , इन अणुओं के बीच स्थिर वैद्युत आकर्षण बल होता है ।
हाइड्रोजन बन्धन का प्रकार
हाइड्रोजन बन्ध दो प्रकार के होते है।
( 1 ) अन्तरआण्विक ( Interatomic ) हाइड्रोजन बन्ध
अन्तरआण्विक हाइड्रोजन बन्ध दो या दो से अधिक अणुओं के मध्य होते हैं , जोकि समान या असमान पदार्थों के हो सकते हैं ।
हाइड्रोजन फ्लोराइड अणुओं के मध्य हाइड्रोजन बन्धन ।
एल्कोहल एवं जल के अणुओं के मध्य हाइड्रोजन बन्धन ।
( 2 ) अन्तराण्विक ( Intra atomic )
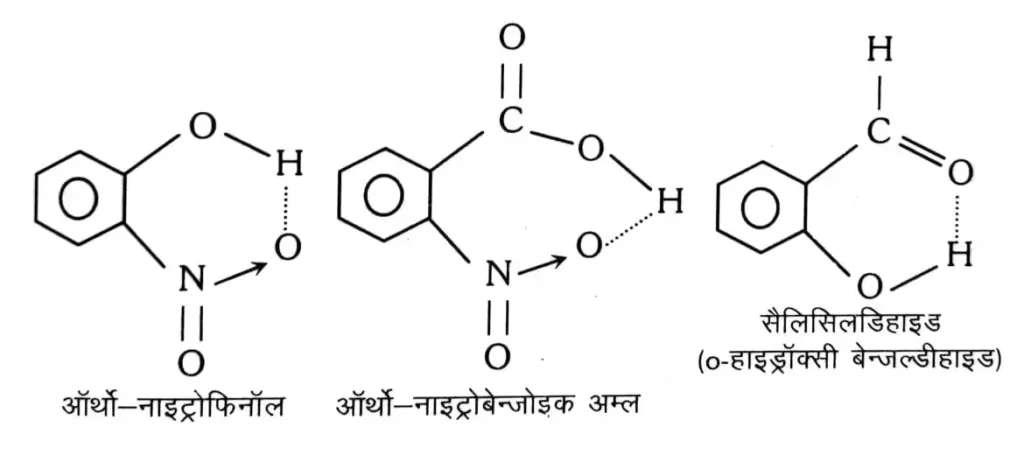
हाइड्रोजन बन्ध ( किलेशन ) इस प्रकार की हाइड्रोजन बन्धुता “ किलेशन ” कहलाती है व यह एक ही अणु के दो परमाणुओं के मध्य होती है ।
यह हाइड्रोजन परमाणु व उच्च ऋणी विद्युतीय परमाणु ( F , O या N ) के मध्य एक ही अणु में होती है । जिसके कारण अणु चक्रियता उत्पन्न हो जाती है व उसके संगुणन करने की क्षमता क्षीण हो जाती है ।
यह मुख्यतः कार्बनिक यौगिकों में पाया जाता है । इसके कारण अणु यौगिक के भौतिक गुणों पर बहुत कम प्रभाव पड़ता है । उदाहरण के लिए ऑर्थो – नाइट्रोफिनॉल व ऑर्थो – बेन्जोइक अम्ल में अन्तराण्विक हाइड्रोजन बन्धन पाया जाता है ।
हाइड्रोजन आबंध के गुण
( Characteristics of H-bond )
- यह एक दुर्बल आकर्षण बल है लेकिन यह वांडरवाल बल से प्रबल होता है तथा इसकी ऊर्जा 10-100 kJmol-1 होती है । जबकि सहसंयोजी बन्ध की ऊर्जा 2.9-418 kJmol-1 होती है ।
- इसे डॉटेड रेखा ( ……….. ) से दर्शाया जाता है ।
- इसे सेतु बन्ध भी कहते हैं ।
- गैसीय अवस्था में यह दुर्बल तथा ठोस अवस्था में यह प्रबल होता है । हाइड्रोजन परमाणु से जुड़े तत्त्व की विद्युत ऋणता बढ़ने पर हाइड्रोजन बन्ध की प्रबलता भी बढ़ती है ।
हाइड्रोजन बन्ध का यौगिकों के गुणों पर प्रभाव
( Effect of H – bond on the Properties of Compound)
हाइड्रोजन बंध बनने के कारण यौगिकों के गुणों पर प्रभाव
भौतिक अवस्था
हाइड्रोजन बन्ध के कारण अणुओं में संगुणन होता है अत : उस यौगिक की भौतिक अवस्था अपेक्षा से भिन्न होती है , जैसे H2O द्रव है क्योंकि H2O में हाइड्रोजन और ऑक्सीजन की विद्युतऋणताओं में अन्तर 1.4 है जबकि H2S में हाइड्रोजन और सल्फर की विद्युतऋणताओं में अन्तर 0.4 है ।
H2O में यह अन्तर बहुत अधिक होने के कारण H2O अधिक द्विध्रुव अणु है अत : जल के अणु आपस में हाइड्रोजन बंध द्वारा संगुणित होकर पास – पास आ जाते हैं अत : H2O द्रव है लेकिन H2S में ऐसा नहीं होता । अत : H2S गैस है । इसी प्रकार HF द्रव होता है जबकि HCl गैस ।
उच्च गलनांक व क्वथनांक
जिन अणुओं में हाइड्रोजन बन्धन होता है , उनका गलनांक व क्वथनांक असामान्य रूप से अधिक पाया जाता है । कुछ अणुओं जैसे ( H2O , HF और NH3 ) आदि में हाइड्रोजन बन्धन के कारण बन्धों को तोड़ने के लिए कुछ अधिक ऊर्जा की आवश्यकता होती है
घुलनशीलता
कुछ ऐसे सहसंयोजी यौगिक हैं जो कि जल में घुल जाते हैं क्योंकि उनके मध्य हाइड्रोजन बन्धन पाया जाता है जैसे कुछ निम्न श्रेणी के एल्कोहल जल में हाइड्रोजन बन्धन के कारण घुलनशील होते हैं ।
अणुभार
अन्तराअणुक हाइड्रोजन बन्ध के कारण दो अणु आपस में संगुणित होकर चक्रीय द्विलक बना लेते हैं । जैसे , ऐसीटिक अम्ल का वाष्प घनत्व विधि से अणुभार ज्ञात करने पर यह 120 आता है जबकि इसका अणुभार 60 होता है क्योंकि इसके दो अणु हाइड्रोजन बंध द्वारा संगुणित हो जाते हैं । अतः संगुणन से यौगिक का अणुभार बढ़ जाता है ।
