यहाँ द्रव्य की प्रकृति [ Nature of matter in Hindi ] द्रव्य पदार्थ की अवस्थाएं से संबंधित सभी महत्वपूर्ण जानकारी दी गई है। इस आर्टिकल में द्रव्य की प्रकृति [ Nature of matter ] द्रव्य पदार्थ की अवस्थाएं ,द्रव्य किसे कहते हैं ? के बारे में विस्तार से जानेंगें।
द्रव्य का वर्गीकरण ( Classification of Matter )
भौतिक अवस्था के आधार पर : ठोस,द्रव,गैस
संघटन के आधार पर : शुद्ध पदार्थ ,तत्त्व ,यौगिक ,मिश्रण ,समांगी मिश्रण ,विषमांगी मिश्रण
द्रव्य की परिभाषा क्या है या द्रव्य किसे कहते हैं ?
हमारे आस – पास स्थित सभी वस्तुएँ द्रव्य से बनी होती हैं अत : कोई भी वह वस्तु जिसका द्रव्यमान होता है तथा जो स्थान घेरती है उसे द्रव्य कहते हैं । द्रव्य, छोटे – छोटे कणों से मिलकर बना होता है ।
उदाहरण – पेन , पुस्तक , वायु , जीव – जन्तु इत्यादि ।
👉द्रव्य की भौतिक अवस्था निश्चित नहीं होती है तथा ताप और दाब के परिवर्तन द्वारा इन्हें एक – दूसरे में परिवर्तित किया जा सकता है ।
👉ठोस को गरम करने पर वह द्रव में तथा द्रव को गरम करने पर वह गैसीय अवस्था में परिवर्तित हो जाता है । इसके विपरीत गैस को ठंडा करने पर वह द्रव में परिवर्तित हो जाती है और इसे अधिक ठंडा करने पर यह ठोस में परिवर्तित हो जाता है ।
द्रव्य का वर्गीकरण ( Classification Of Matter )
द्रव्य का वर्गीकरण दो प्रकार से किया जा सकता है :-
- भौतिक अवस्था के आधार पर ।
- संघटन के आधार पर ।
भौतिक अवस्था के आधार पर ( On The Basis Of Physical State )
भौतिक अवस्था के आधार पर द्रव्य तीन प्रकार का होता है – ठोस , द्रव तथा गैस ।
ठोस ( Solid ) :
- द्रव्य की ठोस अवस्था में कण अत्यधिक निकट तथा क्रमबद्ध रूप से व्यवस्थित रहते हैं तथा इनकी गतिशीलता नगण्य होती है ।
- ठोसों का आयतन तथा आकार निश्चित होता है तथा सामान्यत : ये कठोर एवं दृढ़ होते हैं जिनका घनत्व अधिक होता है ।
- उदाहरण – साधारण नमक , लकड़ी ,पेन्सिल
द्रव ( Liquid ) :
- द्रवों में अवयवी कण ठोसों की अपेक्षा कुछ अधिक दूरी पर होते हैं तथा ये गति कर सकते हैं ।
- द्रव का आयतन निश्चित होता है , परन्तु इनका आकार निश्चित नहीं होता है तथा ये उसी पात्र का आकार ग्रहण कर लेते हैं , जिसमें इन्हें रखा जाता है ।
- द्रवों का घनत्व ठोसों की तुलना में कम होता है तथा इनमें अन्तराअणुक आकर्षण बल कम होता है । द्रवों में तरलता का गुण भी पाया जाता है क्योंकि इनके अणु अव्यवस्थित होते हैं ।
- द्रवों में अणुओं की गतिज ऊर्जा , ठोसों की अपेक्षा अधिक होती है ।
- उदाहरण – तेल , जल , दूध तथा ऐल्कोहॉल
गैस ( Gases ) :
- ठोसों तथा द्रवों की अपेक्षा गैसों में अवयवी कण बहुत दूर – दूर होते हैं । ये आसानी से तथा तेजी से गति कर सकते हैं ।
- गैसों का आयतन तथा आकार निश्चित नहीं होता तथा ये उस पात्र के आयतन में पूरी तरह फैल जाती हैं जिसमें इन्हें रखा जाता है , जिसके कारण कणों के मध्य अधिकांश स्थान रिक्त रहता है , अतः इनकी सम्पीड्यता अधिक होती है ।
- गैसों में अणुओं के मध्य आकर्षण बल नगण्य होता है तथा इनमें अणुओं की गतिज ऊर्जा अधिक होती है ।
- उदाहरण – ऑक्सीजन , नाइट्रोजन , कार्बन – डाइऑक्साइड गैस तथा वायु
Important : कक्षा 11 रसायन विज्ञान नोट्स Chemistry Notes
संघटन के आधार पर ( On the basis of Composition )
संघटन के आधार पर द्रव्य को मिश्रण तथा शुद्ध पदार्थ में वर्गीकृत किया जाता है लेकिन इन्हें पुनः उपवर्गों में विभाजित किया जाता है
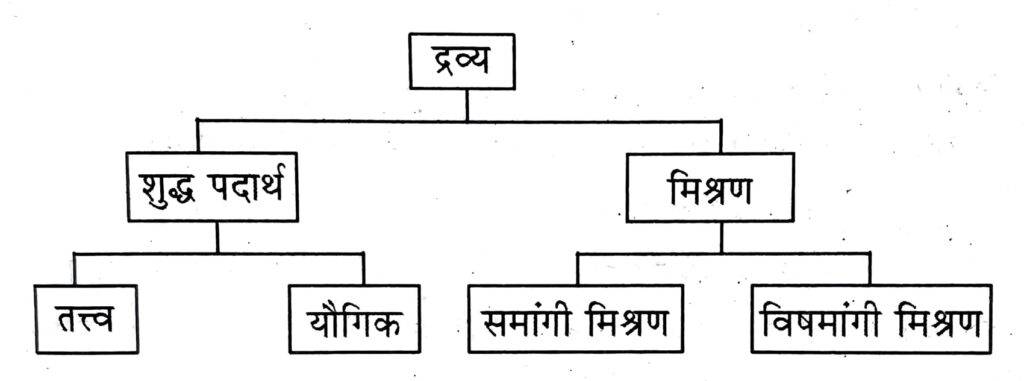
शुद्ध पदार्थ ( Pure substances ) :
- शुद्ध पदार्थों का संघटन निश्चित होता है तथा इनके घटकों को सामान्य भौतिक विधियों द्वारा पृथक् नहीं किया जा सकता ।
- उदाहरण – सोना , चाँदी , लोहा , जल , शर्करा तथा ग्लूकोस । ग्लूकोस में कार्बन , हाइड्रोजन तथा ऑक्सीजन एक निश्चित अनुपात में होते हैं ।
शुद्ध पदार्थों को पुनः तत्त्वों तथा यौगिकों में वर्गीकृत किया जाता है
तत्त्व ( Elements ) :
- वह पदार्थ जिसमें उपस्थित सभी कण ( परमाणु , अणु या आयन ) एक ही प्रकार के होते हैं , उसे तत्त्व कहते हैं ।
उदाहरण – हाइड्रोजन , ऑक्सीजन , सोडियम , चाँदी तथा ताँबा इत्यादि । - सोडियम अथवा ताँबे जैसे कुछ तत्त्वों में एकल परमाणु उपस्थित होते हैं , जबकि अन्य तत्त्वों में दो या अधिक परमाणु मिलकर अणु बनाते हैं , जैसे – हाइड्रोजन , नाइट्रोजन तथा ऑक्सीजन गैसों में अणु उपस्थित होते हैं , जो इनके दो – दो परमाणुओं से मिलकर बने होते हैं ।
- इन सभी में एक ही प्रकार के परमाणु उपस्थित होते हैं , परन्तु विभिन्न तत्त्वों के परमाणु एक – दूसरे से भिन्न होते हैं ।
तत्त्व धातु , अधातु या उपधातु हो सकते हैं ।
यौगिक ( Compounds ) :
- जब भिन्न – भिन्न तत्त्वों के दो या दो से अधिक परमाणु संयोजित होकर अणु बनाते हैं तो उसे यौगिक ( Compounds ) कहते हैं।
- यौगिकों का संघटन निश्चित होता है तथा इनके घटक तत्त्वों को रासायनिक विधियों द्वारा पृथक् किया जा सकता है ।
- उदाहरण – अमोनिया NH3 , जल H2O , कार्बन डाइऑक्साइड CO2 तथा शर्करा C12H22O11
मिश्रण ( Mixtures ):
- मिश्रण वे होते हैं जिनमें दो या दो से अधिक पदार्थ किसी भी अनुपात में उपस्थित हो सकते हैं तथा उनका संघटन भिन्न हो सकता है । हमारे आस – पास उपस्थित अधिकांश पदार्थ मिश्रण हैं ।
- मिश्रण में उपस्थित विभिन्न घटकों को विभिन्न भौतिक विधियों द्वारा पृथक् किया जा सकता है । जैसे – छानना , आसवन , क्रिस्टलन इत्यादि ।
- उदाहरण – हवा , जल तथा शर्करा का मिश्रण , नमक तथा शर्करा का मिश्रण।
मिश्रण दो प्रकार के होते हैं – समांगी तथा विषमांगी
समांगी मिश्रण ( Homogenous Mixture ) :
- समांगी मिश्रण ( Homogenous Mixture ) में उपस्थित घटक एक – दूसरे में पूर्णतया मिश्रित होते हैं तथा पूरे मिश्रण का संघटन एक समान होता है ।
- उदाहरण – ‘ जल में चीनी का विलयन ‘ , ‘ हवा ‘ तथा ऐल्कोहॉल व जल का मिश्रण ।
विषमांगी मिश्रण ( Heterogenous Mixture ) :
- विषमांगी मिश्रण ( Heterogenous Mixture ) का संघटन सम्पूर्ण मिश्रण में एक समान नहीं होता है अर्थात् इनका संघटन असमान होता है तथा कभी – कभी तो विषमांगी मिश्रण के घटक पृथक् – पृथक् दिखाई भी देते हैं ।
- उदाहरण – चीनी तथा नमक , दाल तथा कंकड़ एवं तेल तथा जल का मिश्रण ।
