रासायनिक आबंधन – अष्टक नियम और फॉर्मल आवेश सूत्र से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।
जैसे-
- इलेक्ट्रॉनिकी सिद्धान्त ‘ या अष्टक नियम
- अष्टक नियम की सीमाएँ
- फॉर्मल आवेश
- फार्मल आवेश सूत्र
जैसे महत्वपूर्ण टॉपिक से संबंधित सभी महत्वपूर्ण जानकारी है।
इलेक्ट्रॉनिकी सिद्धान्त या अष्टक नियम
सन् 1916 में कॉसेल तथा लूइस ने परमाणुओं के बीच रासायनिक संयोजन का एक सिद्धान्त दिया था इस सिद्धान्त के अनुसार , परमाणुओं के मध्य बन्ध बनते समय इलेक्ट्रॉनों का एक परमाणु से दूसरे परमाणु पर स्थानान्तरण या इलेक्ट्रॉनों का साझा होता है जिसे ‘ रासायनिक आबंधन का इलेक्ट्रॉनिकी सिद्धान्त ‘ या अष्टक नियम कहते हैं ।
इसमें परमाणु अपने संयोजकता कोश का अष्टक पूर्ण करके स्थायित्व को प्राप्त करते हैं । इसी कारण उत्कृष्ट गैस बन्ध नहीं बनाती है क्योंकि इनमें अष्टक पूर्ण होता है अर्थात् इनके बाह्यतम कोश में आठ इलेक्ट्रॉन होते हैं ।
अष्टक नियम की सीमाएँ ( Limitations of the Octet Rule )
यह मुख्य रूप से दूसरे आवर्त के तत्त्वों पर लागू होता है तथा इसकी सहायता से अधिकांश कार्बनिक यौगिकों की संरचनाओं को समझा जा सकता है । अष्टक नियम के अपवाद
- केन्द्रीय परमाणु का अपूर्ण अष्टक ( इलेक्ट्रॉन न्यून यौगिक ) वे यौगिक जिनके केन्द्रीय परमाणु के चारों ओर उपस्थित इलेक्ट्रॉनों की संख्या आठ से कम होती है । इन्हें इलेक्ट्रॉन न्यून यौगिक कहते हैं । ये यौगिक अष्टक नियम का पालन नहीं करते हैं । उदाहरण LiCl ,BeH2
- वे अणु जिनमें इलेक्ट्रॉनों की कुल संख्या विषम होती है । इनमें सभी परमाणुओं में अष्टक नियम का पालन नहीं होता है । जैसे- NO ( नाइट्रिक ऑक्साइड 15 इलेक्ट्रॉन ) , NO2 ( नाइट्रोजन डाइऑक्साइड ) 23 इलेक्ट्रॉन ।
- अष्टक का प्रसार – आवर्त सारणी के तीसरे तथा इसके आगे के आवर्त के तत्त्वों में बन्ध बनाने के लिए 3s तथा 3p कक्षकों के अतिरिक्त 3d कक्षक भी उपलब्ध होते हैं । इन तत्त्वों के कुछ यौगिकों में केन्द्रीय परमाणु के चारों ओर आठ से अधिक इलेक्ट्रॉन होते हैं , इसे अष्टक का प्रसार कहते हैं । उदाहरण PF5 , SF6 , H2SO4 तथा IF7
- संक्रमण तत्त्वों से बने यौगिकों में संक्रमण तत्त्वों के आयनों बाह्यतम कोश में इलेक्ट्रॉनों की संख्या 9 से 18 तक होती है अत : ये अष्टक नियम का पालन नहीं करते हैं । उदाहरण Tl3+ ( 2,8,9) , Mn2+ ( 2,8,13 ) , Fe2+ ( 2,8,14 ) , Cu+1 ( 2,8,18 ) तथा Zn2+ ( 2,8,18 ) इत्यादि
- अष्टक नियम उत्कृष्ट गैसों की रासायनिक अक्रियता पर आधारित है , परन्तु कुछ उत्कृष्ट गैसों ( जैसे – क्रिप्टॉन तथा जीनॉन ) ऑक्सीजन तथा फ्लुओरीन से क्रिया करके कई यौगिक बनाती हैं । जैसे KrF2 , XeF2 , XeF4
- अष्टक नियम द्वारा अणु की आकृति स्पष्ट नहीं होती है ।
- यह अणु की ऊर्जा , अर्थात् उसके सापेक्ष स्थायित्व की व्याख्या नहीं करता है ।
फॉर्मल आवेश ( Formal Charge )
फॉर्मल आवेश की परिभाषा
बहुपरमाणुक अणु या आयन के किसी परमाणु का फॉर्मल आवेश उसकी विगलित स्थिति ( अर्थात् मुक्त परमाणु अवस्था ) में संयोजकता इलेक्ट्रॉनों की कुल संख्या तथा लूइस संरचना में उस परमाणु को प्रदत्त इलेक्ट्रॉनों की संख्या के अंतर के बराबर होता है ।
फार्मल आवेश सूत्र
फॉर्मल आवेश ज्ञात करना
किसी परमाणु पर फार्मल आवेश = परमाणु में संयोजकता इलेक्ट्रॉनों की कुल संख्या – एकाकी इलेक्ट्रॉनों की कुल – बंधो की कुल संख्या
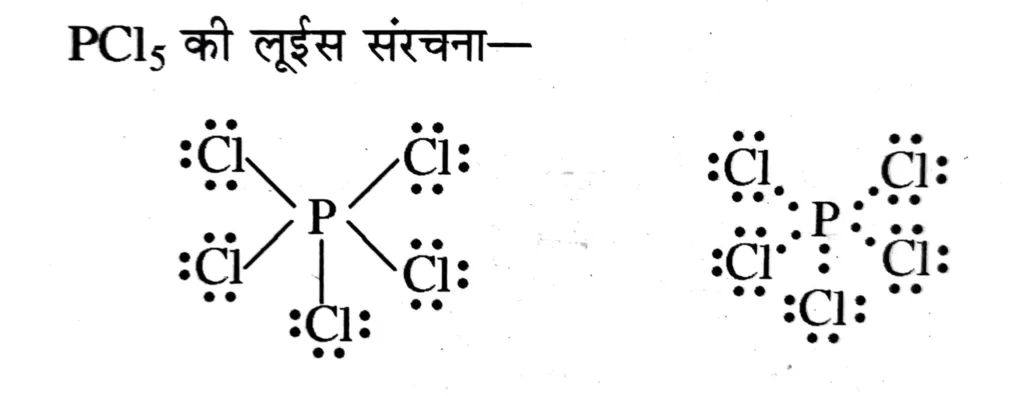
P फार्मल आवेश = 5 – 0 – 5 = 0
Cl फार्मल आवेश = 7 – 6 – 1 = 0
फॉर्मल आवेश से सम्बन्धित महत्त्वपूर्ण तथ्य
- फॉर्मल आवेश का सिद्धान्त आबंधन की शुद्ध सहसंयोजी प्रकृति पर आधारित होता है , जिसमें आबंधित परमाणुओं के मध्य इलेक्ट्रॉनों का समान साझा होता है ।
- एक उदासीन अणु में सभी परमाणुओं के फॉर्मल आवेश का योग शून्य होता है ।
- किसी अणु में जब सभी बन्ध सहसंयोजी होते हैं तो उस अणु में उपस्थित सभी परमाणुओं का फॉर्मल आवेश शून्य होता है ।
- किसी आयन में उपस्थित सभी परमाणुओं के फॉर्मल आवेश का योग , उस आयन पर उपस्थित आवेश के बराबर होता है ।
- जब किसी अणु में उपसहसंयोजी बन्ध उपस्थित होता है तो दाता परमाणु पर फॉर्मल आवेश +1 तथा ग्राही परमाणु पर फॉर्मल आवेश -1 होता है क्योंकि उपसहसंयोजी बन्ध के बनने पर दाता परमाणु से इलेक्ट्रॉन अभ्र ग्राही परमाणु की ओर प्रतिस्थापित होता है ।
