सहसंयोजक बंध किसे कहते हैं उदाहरण ,प्रकार उपसहसंयोजक बन्ध से संबंधित सभी महत्वपूर्ण जानकारी दी गई है।जैसे-
- सहसंयोजक बंध सहसंयोजी आबन्ध
- सहसंयोजक बंध के प्रकार
- सहसंयोजी आबन्ध बनने के नियम
- सहसंयोजक बंध उदाहरण
- सहसंयोजी यौगिकों के सामान्य अभिलक्षण
- उपसहसंयोजी आबन्ध
- उपसहसंयोजी यौगिकों के गुण
जैसे महत्वपूर्ण टॉपिक से संबंधित सभी महत्वपूर्ण जानकारी है।
सहसंयोजक बंध सहसंयोजी आबन्ध
सहसंयोजी आबंध ( Covalent Bond ) सन् 1919 में लैंगम्यूर ने लूइस अभिगृहितों में संशोधन करके उनके स्थान पर सहसंयोजक आबंध का प्रयोग किया । दो समान या असमान विद्युत ऋणी परमाणुओं के मध्य इलेक्ट्रॉन युग्म के साझे से बने बन्ध को सहसंयोजी आबन्ध कहते हैं । उदाहरण Cl2,H2O,CCl2
किसी अणु में उपस्थित वे इलेक्ट्रॉन युग्म जो बन्ध के निर्माण में भाग लेते हैं उन्हें बन्धित इलेक्ट्रॉन युग्म (Bond Pair of Electron) तथा वे इलेक्ट्रॉन युग्म जो बन्ध के निर्माण में भाग नहीं लेते हैं उन्हें अबन्धित या एकाकी इलेक्ट्रॉन युग्म (Lone Pair of Electron) कहते हैं ।
सहसंयोजक बंध के प्रकार
सहसंयोजक बंध तीन प्रकार के होते हैं
एकल बन्ध
जब दो परमाणुओं के मध्य एक इलेक्ट्रॉन युग्म का साझा होता है तो बने बन्ध को एकल बन्ध कहते हैं ।
द्वि – आबंध
जब दो परमाणुओं के मध्य दो इलेक्ट्रॉन युग्मों का साझा होता है , तो उनके बीच बने सहसंयोजी आबन्ध को ‘ द्वि-आबंध ‘ कहते हैं ।
त्रिआबन्ध
जब दो परमाणुओं के मध्य तीन इलेक्ट्रॉन युग्मों का साझा होता है तीन इलेक्ट्रॉन युग्मों के साझे से बने बन्ध को त्रिआबन्ध कहते हैं ।
सहसंयोजी आबन्ध बनने के नियम
- प्रत्येक आबंध का निर्माण परमाणुओं के मध्य एक इलेक्ट्रॉन युग्म के साझे ( Sharing ) से होता है ।
- संयुक्त होने वाला प्रत्येक परमाणु साझे के युग्म में एक – एक इलेक्ट्रॉन का योगदान देता है ।
- इलेक्ट्रॉनों के साझे से संयुक्त होने वाले परमाणु अपने बाह्यतम कोश में सामान्यतः उत्कृष्ट गैस के समान विन्यास प्राप्त कर लेते हैं , अर्थात् उनका अष्टक पूर्ण हो जाता है ।
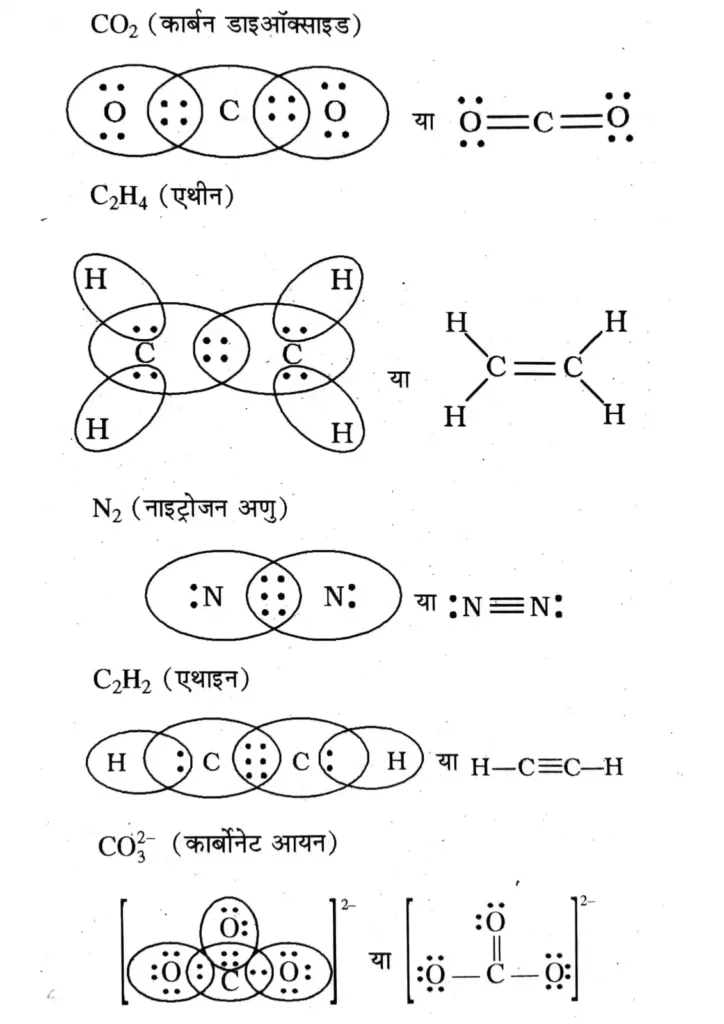
सहसंयोजक बंध उदाहरण
CO2 , C2H4 , N2 , C2H2 , CO32-
यहाँ बिन्दु ( dot ) इलेक्ट्रॉनों को दर्शाते हैं तथा इन संरचनाओं को लुईस बिन्दु संरचनाएँ कहते हैं ।
सहसंयोजी यौगिकों के सामान्य अभिलक्षण ( General Characteristics of Covalent Compounds )
वे यौगिक जिनमें सहसंयोजी बन्ध पाया जाता है उन्हें सहसंयोजी यौगिक कहते हैं । सहसंयोजी यौगिकों लक्षण
भौतिक अवस्था
सहसंयोजी यौगिक कक्ष ताप पर गैस , द्रव या ठोस अवस्था में पाए जाते हैं तथा ये विविक्त अणुओं के रूप में पाए जाते हैं । जिनके मध्य वान्डरवाल बल की प्रबलता के आधार पर ये गैस , द्रव या ठोस होते हैं ।
उदाहरण – गैस- N2 , O2 , F2 , Cl2 , CO2 , इत्यादि द्रव- Br2 , CHCl3 , CCL4 इत्यादि ठोस -I2, SiO2 , हीरा , ग्रेफाइट इत्यादि ।
गलनांक तथा क्वथनांक
सहसंयोजी यौगिकों के गलनांक तथा क्वथनांक आयनिक यौगिकों की तुलना में कम होते हैं क्योंकि इनके अणुओं के मध्य दुर्बल वान्डरवाल बल पाया जाता है जिसे तोड़ने के लिए कम ऊर्जा की आवश्यकता होती है ।
अपवाद – हीरा , ग्रेफाइट , ऐलुमिनियम नाइट्राइड ( AIN ) तथा सिलिकन कार्बाइड या कार्बोइन्डम ( SiC ) के गलनांक तथा क्वथनांक अपेक्षाकृत उच्च होते हैं क्योंकि इनकी त्रिविमीय जालिकाबद्ध संरचना होती है ।
समावयवता
सहसंयोजी बन्ध दृढ़ तथा दिशात्मक होते हैं , अतः सहसंयोजी यौगिकों में समावयवता का गुण पाया जाता है ।
क्रियाशीलता
सहसंयोजी यौगिकों की क्रियाशीलता कम होती है क्योंकि इनमें रासायनिक अभिक्रिया अणुओं के मध्य होती है ( आण्विक अभिक्रिया ) जिनमें बन्ध के टूटने तथा बनने में काफी समय लगता है ।
चालकता
सामान्यतः सहसंयोजी यौगिकों की गलित अवस्था या विलयन में विद्युत का चालन नहीं होता है क्योंकि इनमें मुक्त इलेक्ट्रॉन या मुक्त आयन अनुपस्थित होते हैं ।
अपवाद- ग्रेफाइट ठोस अवस्था में भी विद्युत चालन करता है क्योंकि इसमें परतों के मध्य मुक्त इलेक्ट्रॉन पाए जाते हैं
विलेयता
विलेयता के सामान्य सिद्धान्त ‘ समान समान को घोलता है ‘ ( Like dissolves Like ) के अनुसार आयनिक यौगिक ध्रुवीय विलायकों में तथा सहसंयोजी यौगिक अध्रुवीय विलायकों ( कार्बनिक विलायकों ) में विलेय होते हैं । उदाहरण- CHCl3 , CCl4, बेन्जीन , ईथर , पेट्रोल ,CS2
अपवाद – वे सहसंयोजी यौगिक जो जल के साथ हाइड्रोजन बन्ध बनाते हैं वे जल में विलेय होते हैं जैसे ग्लूकोज , शर्करा , ऐल्कोहॉल
सहसंयोजक बंध किसे कहते हैं ? उदाहरण सहित बताइए?
दो समान या असमान विद्युत ऋणी परमाणुओं के मध्य इलेक्ट्रॉन युग्म के साझे से बने बन्ध को सहसंयोजी आबन्ध कहते हैं ।
उदाहरण- Cl2, H2O, CCl4
सहसंयोजक बंधन कितने प्रकार के होते हैं?
सहसंयोजक बंधन तीन प्रकार के होते हैं
एकल बन्ध
द्वि-आबंध
त्रिआबन्ध
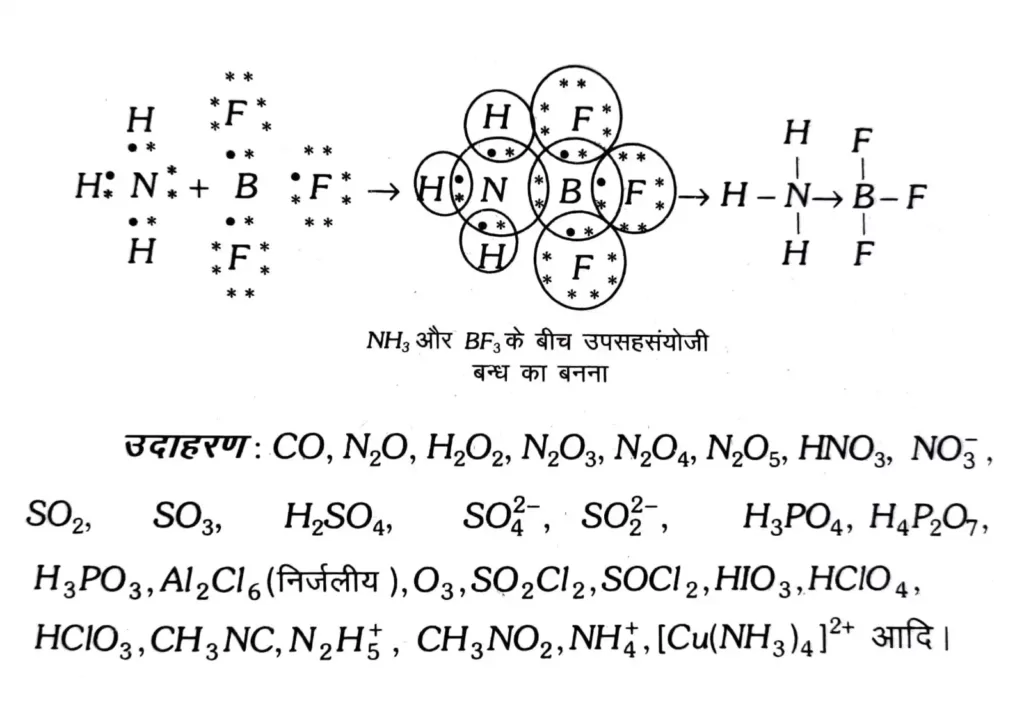
उपसहसंयोजी आबन्ध ( Coordination Bond ) उपसहसंयोजक बन्ध
जब दो परमाणुओं के मध्य इलेक्ट्रॉनों के असमान साझे से बन्ध बनता है तो इसे उपसहसंयोजी बन्ध कहते हैं अर्थात् उपसहसंयोजी बन्ध बनते समय साझे के लिए दोनों इलेक्ट्रॉन एक ही परमाणु द्वारा दिए जाते हैं जिसे दाता परमाणु व दूसरे परमाणु को ग्राही परमाणु कहा जाता है।
इसे दाता से ग्राही की ओर एक तीर के निशान ( ) द्वारा दर्शाया जाता है लेकिन साझे के इलेक्ट्रॉन युग्म को दोनों परमाणुओं पर ही माना जाता है ।
अतः उपसहसंयोजी बन्ध एक विशेष प्रकार का सहसंयोजी बन्ध होता है ।
उपसहसंयोजी बन्ध बनने के लिए दाता परमाणु के पास न्यूनतम एक एकाकी इलेक्ट्रॉन युग्म तथा ग्राही परमाणु के पास एक रिक्त कक्षक होना चाहिए ।
उपसहसंयोजी यौगिकों के गुण
- इनके गलनांक व क्वथनांक शुद्ध सहसंयोजी यौगिकों से अधिक तथा शुद्ध आयनिक यौगिकों से कम होते हैं ।
- यह जल अर्थात् ध्रुवीय विलायकों में अत्यंत कम घुलनशील व कार्बनिक विलायकों में शीघ्रता से घुलने वाले होते हैं ।
- यह विद्युत के अच्छे चालक नहीं हैं । इनमें विलेय अवस्था तथा गलित अवस्था में भी विद्युत का चालन नहीं हो पाता है ।
- ये बन्ध दृढ़ तथा दिशात्मक होते हैं अतः उपसहसंयोजी यौगिक समावयवता प्रदर्शित करते हैं ।
- ऐसे यौगिक जिनमें उपसहसंयोजी बंध होता है उनके परावैद्युत स्थिरांक का मान उच्च होता है ।
